单臂试验 ORR可能不够?FDA即将召开ODAC会议 决定PI3K靶向血液肿瘤产品的未来
作者:识林-木兰
FDA将在4月21-22肿瘤药物专家咨询委员会日召开(Oncologic Drugs Advisory Committee,ODAC)会议讨论投票,企业是否应通过随机对照试验数据作为支持有效性和安全的实质性证据,批准投票PI3K(磷脂酰肌醇-3-激酶抑制剂?PI3K 抑制剂产品在血液系统恶性肿瘤中未来发展的命运。

2一个月前,信达PD-1受阻于ODAC,在中国引起轩然大波,ODAC但步伐依旧PI3K会议的特殊之处在于,这不是产品或临床试验的得失。背后是产品或临床试验的得失。FDA基于靶点机制,综合考虑其临床研究设计和临床终点选择。或许,这是国内创新药企充分了解的又一次FDA以监管为导向的宝贵一课。
本文简要总结了当前的公共信息,供用户了解背景。
ODAC关注核心问题的问题
原计划召开为期两天的会议:
第一天讨论:企业是否应通过随机对照试验数据作为支持有效性和安全性的实质性证据,批准PI3K抑制剂?
第二天讨论
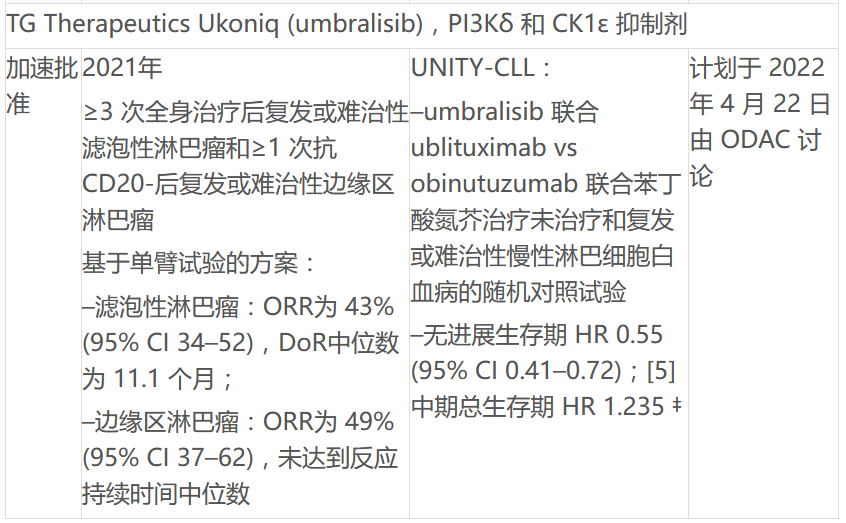
现在“umbralisib和ublituximab关于治疗慢性淋巴细胞白血病或小淋巴细胞淋巴瘤的成年患者的补充申请已经取消,TG补充申请已被撤回。
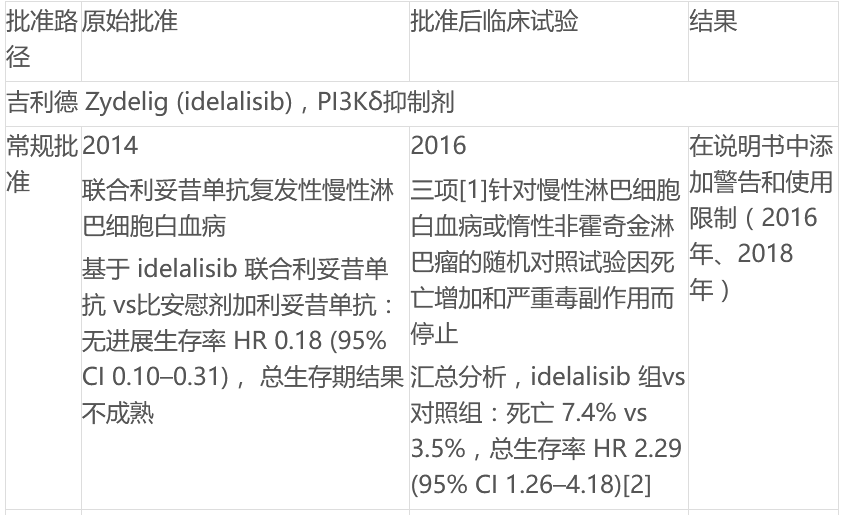
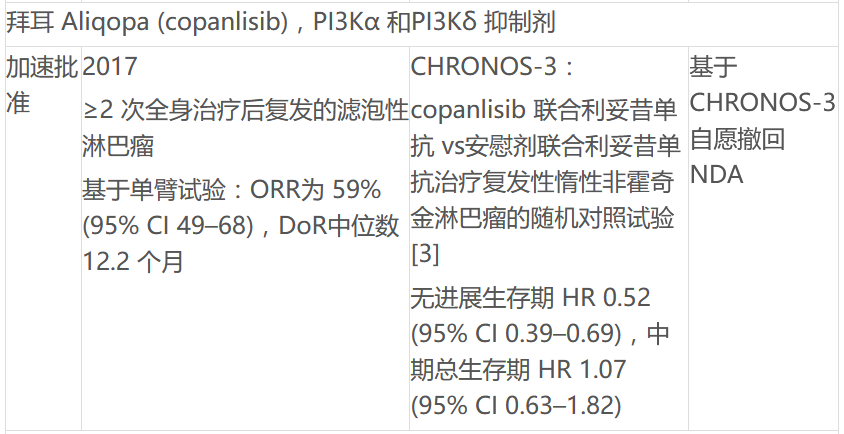
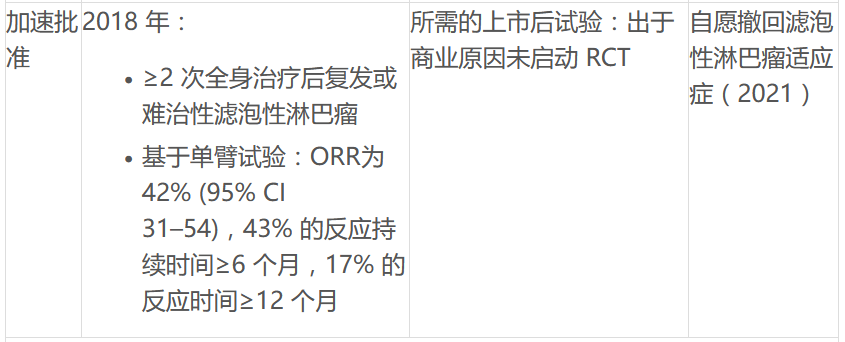
ODAC将讨论FDA批准的4种PI3K抑制剂用于各种血液肿瘤,包括吉利德Zydelig,拜耳的Aliqopa,SecuraBio的Copiktra和TG的Ukoniq。PI3K它曾被认为是癌症主要调节剂方式的一部分,但它曾被认为是癌症的主要调节剂PI3K抑制剂因毒性问题、剂量优化不足、单臂研究试验设计限制和整体生存趋势而受到质疑。FDA已批准4个PI3K慢性淋巴细胞白血病抑制剂(CLL)、小淋巴细胞淋巴瘤(SLL)、滤泡性淋巴瘤(FL)和边缘淋巴瘤(MZL)病人。目前正在发展中B细胞和T细胞非霍奇金淋巴瘤和其他适应症。但一些产品已经取消了一些适应症,吉利德取消了一些适应症。Zydelig复发性滤泡性B由于药物确证性试验招募的持续挑战,细胞非霍奇金淋巴瘤和复发性小淋巴细胞白血病的适应症。
似曾相识的会前铺垫?
4月14日,FDA肿瘤学优秀中心(Oncology Center of Excellence,OCE)官员Nicholas等人在《柳叶刀》中-肿瘤学:
血液系统恶性肿瘤PI3K抑制剂的开发计划突出了目前单臂试验中使用的整体缓解率(ORR)支持与加速批准范式相关的挑战。通常,在为随后的单臂试验选择最大或接近最大耐受剂量加速批准之前,剂量探索研究是有限的。
文中也总结了FDA用于血液系统恶性肿瘤的 PI3K 抑制剂现状: 抑制剂现状:


另外,在ODAC会议资料中,FDA提交了一份93页的简报。
简报中,FDA指出,项随机对照试验结果的一致性是前所未有的——PFS在优势或潜在优势的背景下,总生存期下降。整体生存信息是早期的,代表的事件很少,但是,FDA在多个实验中观察到相同的模式。此外,在每一个实验中,由于每一个实验,因为。PI3K抑制剂组不良事件造成的死亡率较高,说明对总生存期的潜在损害可能是毒性造成的。许多评估PI3K抑制剂单药或与其他药物联合使用的随机试验显示出明显的毒性,随机分配到PI3K抑制剂组患者通常会发生致命的不良事件(AE)、严重AE、≥3级AE和AE相关发病率增加治疗暂停或调整。在单药治疗试验中,致命的发病率增加。AE范围为1%-5%,≥3级AE为51%-85%,严重AE为26%-65%,停药率高达35%。
FDA认为,PI3K血液系统恶性肿瘤中使用抑制剂的经验表明,单臂试验中使用 ORR 支持初步批准范式所面临的挑战:
剂量优化:在选择最大或接近最大耐受剂量进行后续注册试验时,对较低剂量的探索有限。尽管与此类药物有关AE存在暴露-反应关系,但不一定观察到疗效的暴露-反应关系。用更强的剂量探索试验来澄清ORR与毒性的关系可以避免选择过量的毒性剂量,从而导致毒性过量的剂量OS相关趋势Optimus项目下,目前FDA建议在开始注册试验前强调剂量反应和安全性评估。
单臂试验的局限性:在某些情况下,选择单臂研究和设计进行初始注册的后果变得复杂。由于缺乏对比,单臂试验数据的安全分析令人困惑,这可能会给予它AE准确归因于药物或潜在疾病带来的挑战。因为申请人可能没有仔细考虑好处-在风险分析的情况下,选择达到最高水平ORR剂量,所以毒性很复杂,可能会导致这些药物中的多个RCT令人担忧的中间反复出现OS结果。此外,虽然单臂试验允许评估ORR,但它们无法准确评估PFS和OS。随机试验是控制混合因素,允许评估PFS、OS最有效的方法等重要指标的最有效方法。
OS终点重要性:应全面收集分析OS数据,因为OS它是确定收益风险的重要指标,特别是对毒性明显的产品。为了充分评估生存率和其他临床效益测量值,应进行前瞻性的随机试验。
