海思科BTK抑制剂,荣昌生物PD-L1单抗、新立泰创新药获临床!
发布时间: 2022-04-21 16:01:53
目录
海思科:BTK蛋白抑制剂在美国获批
罗氏:与梯瓦制药达成创新战略合作
赛诺菲:度普利尤单抗在欧盟获批新适应症
信立泰:HFpEF药品SAL007受理临床试验申请
荣昌生物:PD-L1单抗注射用RC98获批临床
- 海思科:BTK蛋白抑制剂在美国获批
415月15日,海思科发布公告,海思科发布公告BTK蛋白抑制剂HSK29116美国临床试验申请(IND)获FDA许可证。本次临床试验是对复发或难治性药物的评价B细胞恶性肿瘤受试者的安全性、耐受性和药代动力学/药效学。

截图来源:企业公告
据公告,HSK29116是海思科自主研发的靶向 BTK 的口服 PROTAC 小分子抗肿瘤药物,用于治疗复发难治 B 细胞淋巴瘤是中国第一个进入临床研究的进入临床研究的 BTK-PROTAC 药物。2021年4月获国家药品监督管理局称号(NMPA)目前,我国和澳大利亚的临床剂量爬坡试验正在迅速推进,已进入第四个剂量组,进展良好。美国的临床实践将是 HSK29116 全球多中心研究的重要组成部分即将正式启动I 期临床试验。
- 罗氏:与梯瓦制药达成创新战略合作
4月18日,罗氏制药宣布与以色列知名制药公司梯瓦制药公司(以下简称Teva达成合作协议,双方将整合各自的优势资源,进一步扩大盐酸苯达莫司汀-存达在中国的患者。
存达?是Teva公司自主研发的原盐酸苯达莫司汀于2018年在中国获批,是公司自主研发的盐酸苯达莫司汀Teva公司上市的原研产品用于治疗利妥昔单抗或含利妥昔单抗治疗过程中/治疗后疾病进展的惰性B细胞非霍奇金淋巴瘤(NHL)。
- 赛诺菲:度普利尤单抗在欧盟获批新适应症
4赛诺菲19日,赛诺菲(Sanofi)发布新闻稿称,欧盟委员会表示,(EC)已扩大达必妥(度普利尤单抗)在欧盟的上市许可证,批准其用于欧盟。6~11岁,中高剂量吸入型糖皮质激素(ICS)2型炎症性重度哮喘患者的附加维持治疗方案与另一种维持治疗药物结合后控制不良。根据赛诺菲的新闻稿,度普利尤单抗是欧盟批准的唯一适用于2型炎症性重度哮喘的生物制剂。
- 信立泰:HFpEF药品SAL007受理临床试验申请
4月19日,新立泰宣布重组人神经调节蛋白1-抗HER3抗体融合蛋白注射液(国内项目代码:SAL007)受理临床试验申请。本公司提交的申请为:SAL007慢性心力衰竭HFpEF(射血分数保留的心力衰竭)适应症I期临床试验申请。

SAL007(美国项目代码:JK07,下称07Salubris Bio自主研发,拥有全球知识产权NRG-1(神经调节蛋白-1)结合抗体药物,拟开发的适应症是慢性心力衰竭。
据悉,该产品是新立泰第一款中美双报创新生物药,2020年2月获得美国美国双报,FDA2020年9月获得中国临床试验批准,获得中国临床试验批准CDE临床试验批准。目前,美国,美国。Salubris Bio正进行HFrEF(心力衰竭)I期临床试验第二剂量组入组,预计近期完成;同时,正在准备中,HFpEF临床试验开始工作。中国正在进行临床试验。HFrEF的I期临床试验。
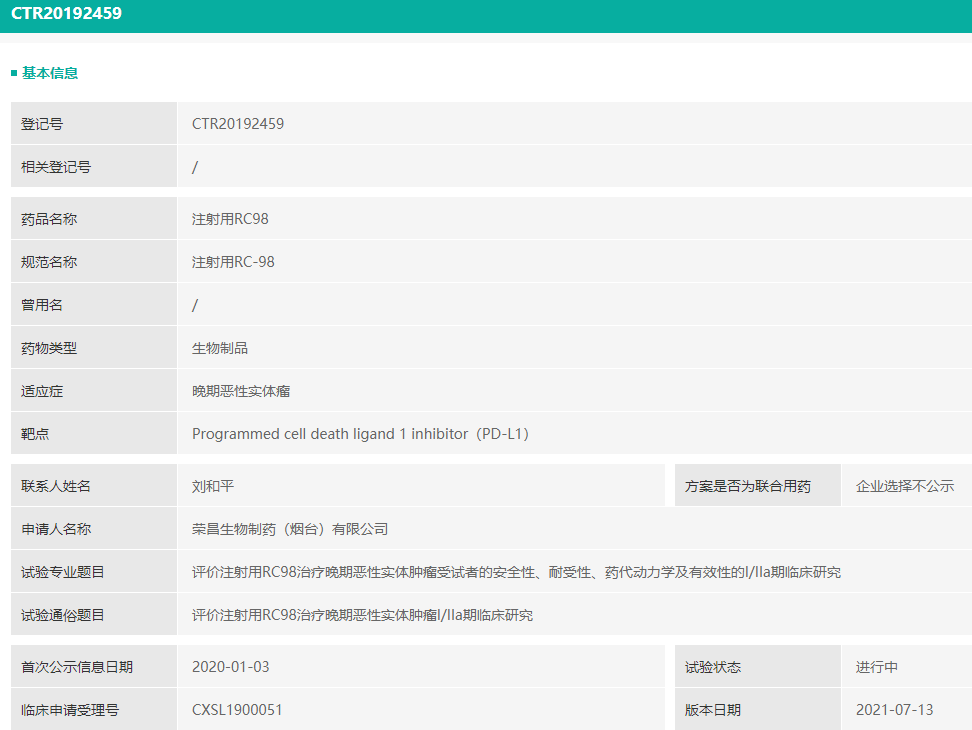
- 荣昌生物:PD-L1单抗注射用RC98获批临床
CDE官网显示,近日荣昌生物注射用RC98获批临床、治疗HER2表达胃癌。

截图来源:CDE官网
据了解,RC98为PD-L1单克隆抗体。此前获批临床,适应症为实体瘤,目前正在进行中。I/IIa期临床研究。
截图来源:药融云中国临床试验数据库
