默沙东约8.7引进亿美元!GLP-1R/GCGR双重激动剂在中国获得临床批准
419月19日,中国国家食品药品监督管理局药品评价中心(CDE)根据官网公示,默沙东(MSD)申报的一类新药MK-6024注射液在我国已获批准临床实践,拟开发的适应症为非酒精性脂肪性肝炎(NASH)。公开资料显示,MK-6024(efinopegdutide)每周一次GLP-1R/GCGR双重激动剂目前正处于世界两期临床试验阶段。2020年8月,默沙东以高达高达。8.71亿美元获得该产品在美国和全球开发和推广的独家许可。
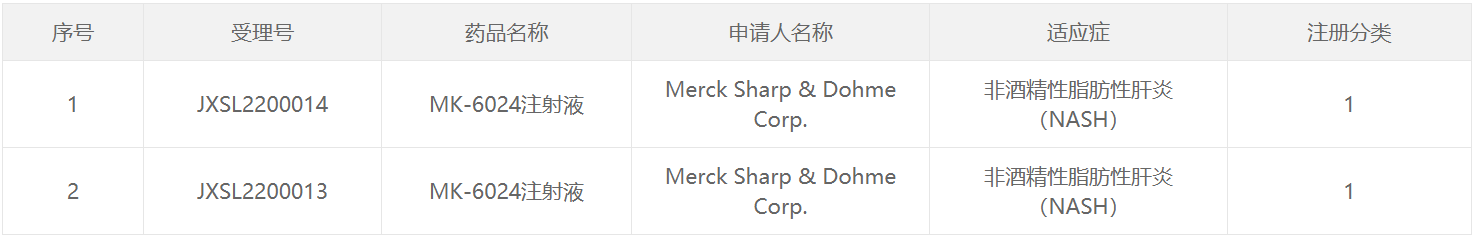
截图来源:CDE官网
GLP-1R和GCGR是G蛋白质偶联受体家族成员是维持人体血糖平衡的两个重要调节器。GLP-1R胰高血糖素样肽-1(GLP-1)受体主要在摄食后发挥作用,通过与其配体发挥作用GLP-1结合,刺激胰岛素分泌,使餐后血糖降低并保持在正常水平;GCGR胰高血糖素(glucagon)在饥饿状态下,GCGR结合胰高血糖素,提高人体血糖水平。
研究表明,GLP-1R/GCGR双重激动剂具有多种功能式,不仅可以激活GLP-1R,改善胰岛素分泌,减少食物摄入,激活胰岛素GCGR减少炎症和脂肪生成。GLP-1R/GCGR双重激动剂疗法已成为治疗糖尿病、肥胖、非酒精性脂肪性肝炎等疾病的新方向。
Efinopegdutide正是韩美公司(Hanmi Pharmaceutical)开发的合成、修饰性胃泌酸调节素(OXM)肽。OXM作用于双重激动剂的双重激动剂GLP-1R和GCGR。20202008年8月,默沙东以高达8.71亿美元与韩国和美国达成合作,以获得该产品在美国和世界各地开发和推广的独家许可。公开数据显示,该产品在许多一、二期临床试验中评估了安全性和有效性,包括治疗伴有和不伴有2型糖尿病的严重肥胖患者。
ClinicalTrials官网显示,默沙东正在海外开展一项工作efinopegdutide治疗非酒精性脂肪肝(NAFLD)两期临床试验。临床试验将进行评估。efinopegdutide与司美格鲁肽相比,NAFLD治疗24周后,患者肝脏脂肪含量平均下降。
公开数据显示,随着肥胖和代谢综合征的流行,非酒精性脂肪肝(通常称为脂肪肝)已成为常见的慢性肝病之一。其中之一。NASH是NAFLD肝硬化和肝移植成为肝硬化和肝移植的主要原因之一。
本次efinopegdutide在中国获批临床试验,意味着它即将在中国进行临床试验。
参考资料:
[1]中国国家食品药品监督管理局药品评审中心(CDE)官网. Retrieved Apr 19 ,2022. From https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2] Merck and Hanmi Pharmaceutical Enter into Licensing Agreement to Develop Efinopegdutide,an Investigational Once-Weekly Therapy for Nonalcoholic Steatohepatitis (NASH). Retrieved Aug 4 ,2020. From https://www.merck.com/news/merck-and-hanmi-pharmaceutical-enter-into-licensing-agreement-to-develop-efinopegdutide-an-investigational-once-weekly-therapy-for-nonalcoholic-steatohepatitis-nash/
