复宏汉霖利妥昔单抗新适应症即将被批准治疗类风湿性关节炎
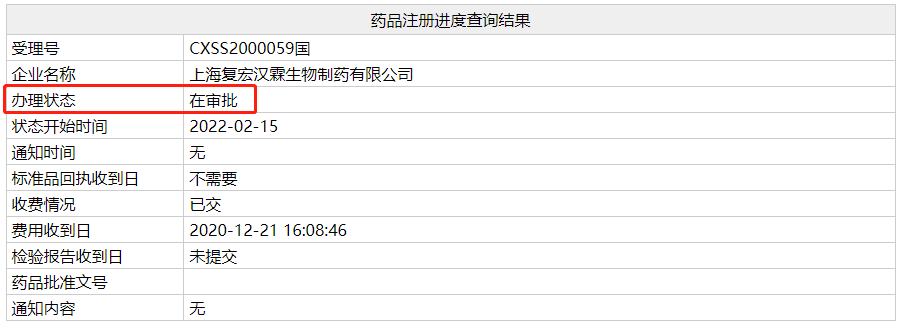
近日,NMPA 官网显示,复宏汉霖的利妥昔单抗生物类似药物(HLX01、汉利康)新适应症上市申请(受理号:CXSS2万59)进入行政审批阶段,预计近期获批。根据富宏汉霖披露的信息,这种适应症是类风湿性关节炎。值得一提的是,原研利妥昔单抗在中国尚未获批。点击此处查看受理号的状态
汉利康由复宏汉林自主研发,最早于2019年2月22日获批在中国上市,也是中国第一个根据2015年发布的生物类似药物研发评价技术指导原则(试行)开发批准生物类似药物,可用于非霍奇金淋巴瘤和白血病治疗,全面覆盖中国批准的所有适应症。今天也是汉利康上市三周年。
鉴于原研利妥昔单抗的类风湿性关节炎适应症仅在美国和欧盟获得批准,但尚未在中国获得批准。在开发血液肿瘤的基础上,复宏汉霖针对 HLX01(利妥昔单抗注射液)采取差异化发展策略,积极探索其在类风湿性关节炎患者中的疗效。汉利康对类风湿性关节炎的新适应症上市申请主要基于 I 期临床试验 HLX01-RA01 和 III 期临床试验 HLX01-RA关键研究数据03 。
HLX01-RA 2019年欧洲风湿病学会临床数据 (EULAR)年会发布,研究结果显示 HLX01 在药代/药效动力学和安全性方面与欧盟利妥昔单抗高度相似,能有效支持后续临床 III 期试验 (HLX01-RA 的发展。
HLX01-RA03 是对甲氨蝶呤治疗的一种反应(MTX-IR)中重度活动性类风湿关节炎受试者评价 HLX01(利妥昔单抗注射液)联合甲氨蝶呤(MTX)随机、双盲、安慰剂对照治疗的有效性和安全性 III 期临床研究,主要研究人员为北京协和医院风湿免疫科曾晓峰教授。本研究的主要终点是第24周达到美国风湿病学会20% 缓解标准(ACR20)受试者比例,次要有效性终点包括 28 关节疾病活动性评分(DAS28)、达到 ACR20/50/70 缓解标准的受试者比例等。HLX01(利妥昔单抗注射液)MTX 在 MTX-IR 中重度活动RA 受试者安全有效。
据 Insight 数据库,目前国内包括原研在内的 3 利妥昔单抗已获批上市,两种生物类似药物分别来自复宏汉林和信达生物。此外,正大天晴也在上市审查中,5 企业的利妥昔单抗生物类似药物也在 III 期临床开发阶段。

公开数据显示,2019年中国利妥昔单抗销售额约为 25.2020年上半年约为 11亿元.02 亿元。
