20223月份临床研究失败TOP10
文章来源:医药魔方Med
作者:树叶
3月,罗氏TIGIT免疫药物Tiragolumab未能接棒LAG3“好运气”,闯关失败;偏向型IL-2临床失利,导致Nektar股价下跌超60%;选择性雌激素受体降解剂amcenestrant乳腺癌II期临床错失主要终点;PD-1/L1免疫疗法共同面对不利消息,两家反义疗法研究受挫等。在此,为大家筛选临床研究失利TOP10,以供参考。
1. Tiragolumab联合阿替利珠单抗治疗广泛期小细胞肺癌的III期研究
3月30日,罗氏宣布TIGIT抗体tiragolumab联合阿替利珠单抗和化疗(卡铂和依托泊苷)作为广泛期小细胞肺癌( ES-SCLC )患者初始(一线)治疗的III期临床试验(SKYSCRAPER-02)未达到无进展生存期的共同主要终点,并且在计划的最终分析中也不太可能达到统计学意义。
SKYSCRAPER-02研究是一项全球 III 期、随机、安慰剂对照的双盲研究,在490名广泛期患者中评估tiragolumab联合阿替利珠单抗和化疗对比阿替利珠单抗和化疗在小细胞肺癌中的疗效。阿替利珠单抗是第一个在 ES-SCLC(III 期IMpower133研究)中显示出生存获益的肿瘤免疫疗法,并且也是第一个在该适应症中获得批准的免疫疗法。PD-1/L1免疫疗法之后,业界一直探索新的免疫疗法,TIGIT便是其中热门追逐的靶标之一,先后吸引了罗氏、吉利德、默沙东、诺华等国际巨头入局,同时国内外企业也在基于TIGIT开发特异性双抗疗法。
TIGIT全称T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains),也是一种抑制性受体,在多种类型的T细胞和NK细胞表面表达。Tiragolumab是一种全人源 IgG1/kappa 抗TIGIT单克隆抗体,具有完整的Fc区,可阻断TIGIT与其配体 PVR 和共激活受体CD226的结合,理论上可恢复抗肿瘤反应并增强抗PD-L1抗体疗效。
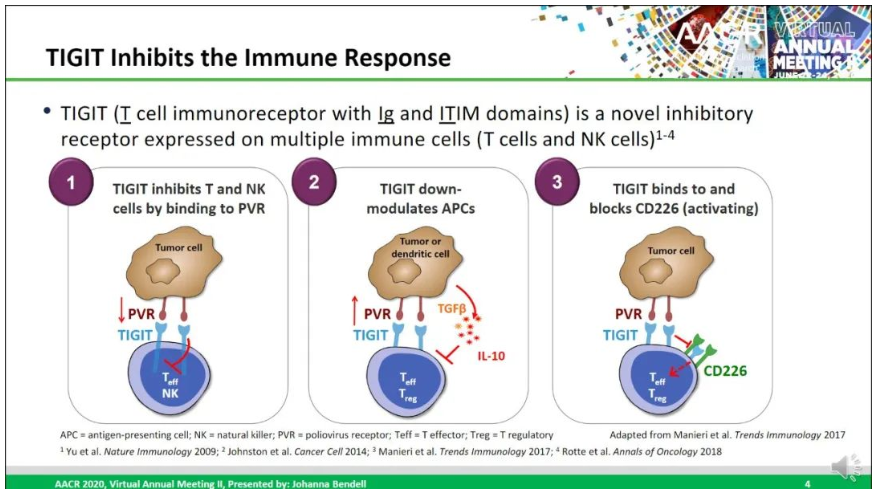
Tiragolumab是罗氏重点开发的下一代免疫检查点抑制剂之一,SKYSCRAPER-02也是罗氏针对tiragolumab开展的五项 III 期试验之一。同时,SCLC又是恶性程度较高的一类肺癌,多种不同机制药物也都折戟成沙。因此,在SCLC中的研究失利并不能决断TIGIT策略失败。毕竟LAG3固定剂量药物Opdualag同期刚刚获批上市,而TIGIT和LAG3相似,都是没有单方活性的新型免疫靶标。另一方面,与非小细胞肺癌试验(SKYSCRAPER-01和-03)不同,SCLC早期数据并没有公开披露。而Tiragolumab作为罗氏重点开发的产品在2021年被FDA授予治疗PD-L1高表达转移性非小细胞肺癌的突破性疗法,早期数据显示客观缓解率的改善和疾病恶化或死亡风险的降低。
SKYSCRAPER-02研究数据将在后期举行的医学会议上公布,但总的来说,TIGIT靶标并没有起到“雪中送炭”的作用。PD-1/L1免疫疗法之后,我们需要解决的如何扩大免疫疗法的获益人群,尤其PD-1/L1治疗无响应或不耐受人群中的新疗法,似乎TIGIT和LAG3目前并未表现出这样的潜质。
2. NKTR-214联合Opdivo治疗黑色素瘤的两项III期研究
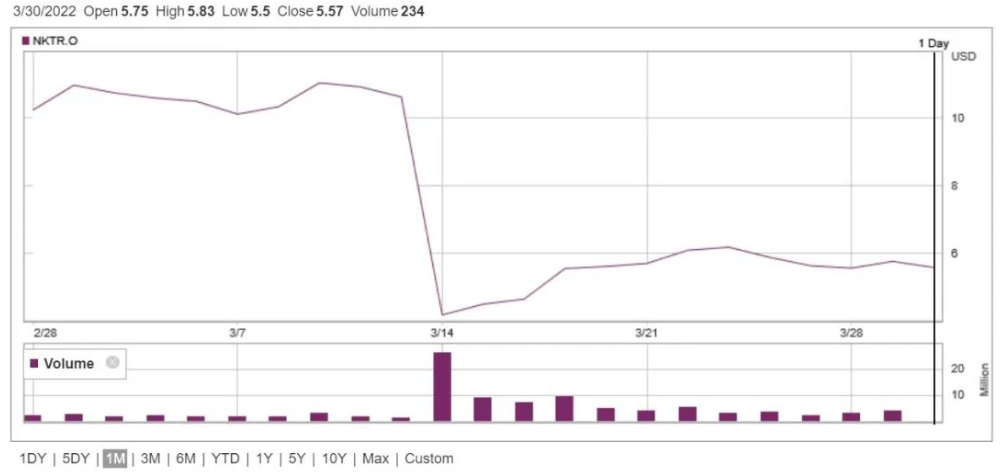
3月14日,百美施贵宝和 Nektar Therapeutics 联合宣布了bempegaldesleukin (NKTR-214)联合纳武利尤单抗相较于纳武利尤单抗单药在先前未经治疗的不可切除或转移性黑色素瘤的临床III期研究(PIVOT IO-001)首次数据分析结果。结论指出,经盲态独立中央审查 (BICR) 评估,该研究未达到无进展生存期和客观缓解率的主要终点,总生存期作为第一次中期分析中的第三个主要终点也不符合统计学意义。受此消息影响,Nektar股价当天下跌超过60%,收于4.16美元。
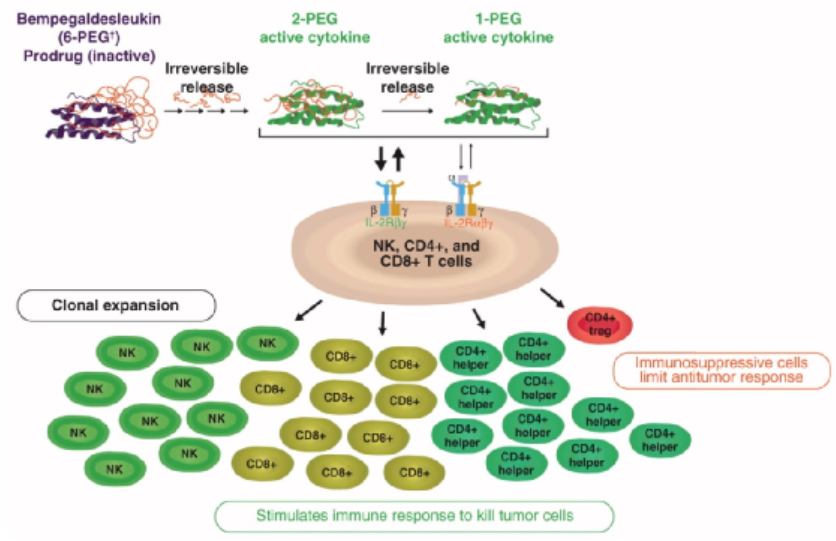
Bempegaldesleukin (BEMPEG/NKTR-214) 是一种免疫刺激性 IL-2 细胞因子前药,经过工程化改造,由平均与六个聚乙二醇 (PEG) 链偶联的 IL-2 组成,旨在通过结合 IL-2Rβγ 受体而不结合抑制免疫的调节性T细胞IL-2Rαβγ受体,提供快速和持续的信号传导,选择性刺激和扩增特定的抗癌T细胞和自然杀伤 (NK) 细胞。同时,NKTR-214也被设计为通过其PEG 链的缓慢释放来增加 IL-2 的半衰期(~20 小时),从而实现持续(超过3周)激活IL-2途径,以减少给药频率。
此外,基于独立数据监测委员会 (DMC)对PIVOT IO-001研究的审查结果,两家公司还决定停止招募并揭盲正在进行的辅助性黑色素瘤临床III期PIVOT-12研究,该研究旨在评估在高复发风险患者中完全切除黑色素瘤后,NKTR-214联合纳武利尤单抗相较于单独使用纳武利尤单抗的辅助免疫治疗功效。
NKTR-214最初由Nektar Therapeutics开发,百时美施贵在2018年以18.5亿美元首付款(含股权投资)签署合作开发协议,Nektar股价随后也一度飙升至108美元。尽管NKTR-214和纳武利尤单抗联用曾在早期研究中显示对皮肤癌、肾癌和膀胱癌的治疗响应,但这些研究并没有设置对照组,也使得NKTR-214在纳武利尤单抗基础上能够增加多少临床益处变得扑朔迷离,在这个基础上贸然推进至III期临床自然也就增添了不确定性。不过,两家公司决定继续推进在肾细胞癌和膀胱癌中的相关临床探索,包括III期临床。
3. 度伐利尤单抗治疗局部晚期宫颈癌III期研究
3月24日,阿斯利康宣布,PD-L1单抗Imfinzi (度伐利尤单抗) 联合放化疗(CRT)治疗局部晚期宫颈癌的III期CALLA研究未达到改善无进展生存期(PFS)的主要终点。与单纯放化疗相比,PFS未实现统计学意义改善。
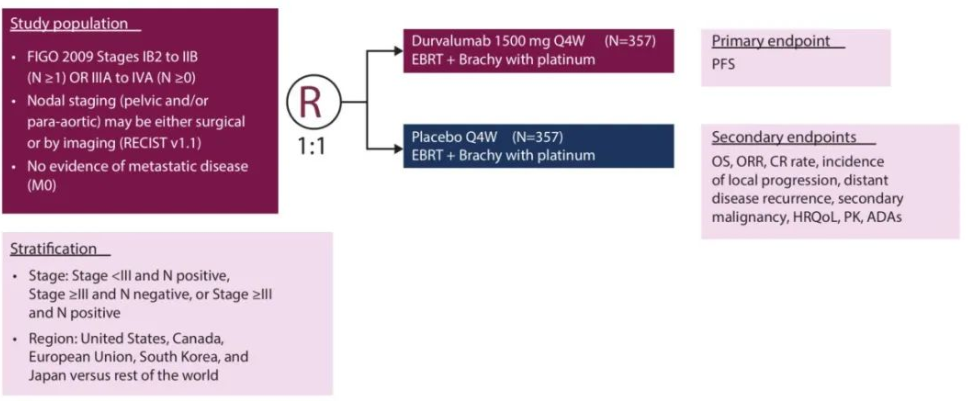
CALLA研究是一项随机、多中心、双盲、全球性III期临床试验,最终770名局部晚期宫颈癌患者接受了标准治疗CRT联合1500 mg固定剂量Imfinzi或安慰剂治疗,受试者每四周治疗一次,持续24个周期或直到疾病进展。该试验在包括美国、欧洲、拉丁美洲、非洲和亚洲在内的15个国家的120个中心进行。主要终点为无进展生存期(PFS),主要次要终点包括总生存期、安全性和耐受性。
宫颈癌是全球第八大最常见、第九大最致命的癌症,每年约有60万确诊病例。约40-50%宫颈癌患者确诊时已处于局部晚期。按照目前的治疗标准铂类化疗联合放疗,局部晚期宫颈癌患者的复发率约为40%,5年生存率约为65-70%。临床前数据显示,同步放化疗联合阻断PD-1/L1途径可通过启动DNA断裂、细胞死亡、吞噬作用和抗原呈递来诱导免疫原性环境增加,从而导致免疫介导的肿瘤重新激活和增强的抗肿瘤活性。
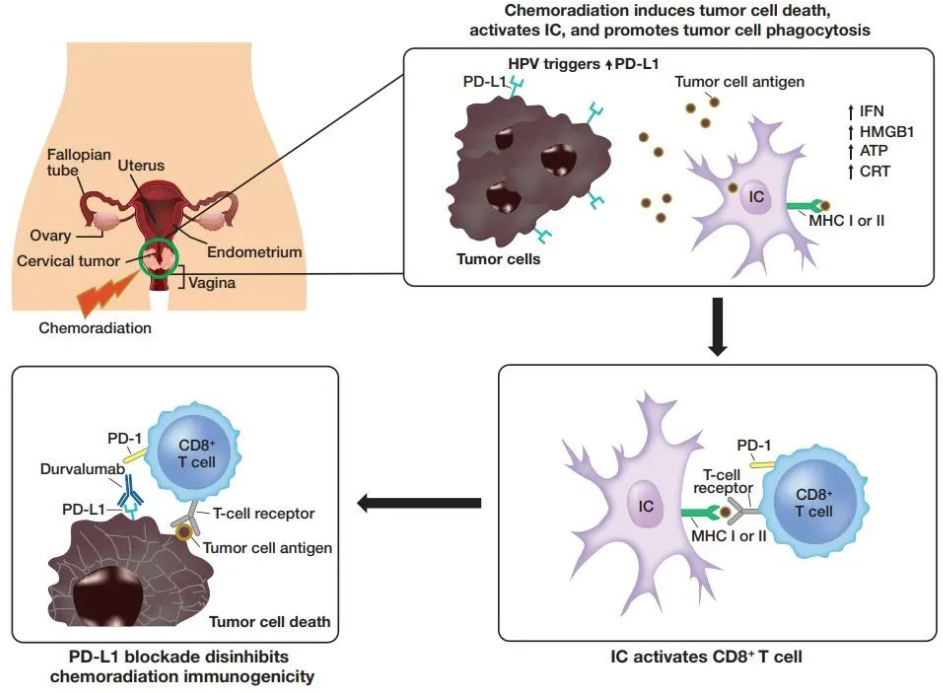
在这一领域,阿斯利康对Imfinizi寄予厚望,希望可以与默沙东的 PD-1帕博利珠单抗展开竞争。帕博利珠单抗在2021年10月获得了与化疗联合治疗持续性、复发性或转移性宫颈癌的一线疗法资格。CALLA研究的失败使得阿斯利康希望破灭,但这并不是PD-1/L1疗法的首次失利。2022年1月,作为首个在III期临床中证明可改善铂类化疗后疾病进展总生存期的PD-L1抗体西米普利单抗也撤销了该适应症;再往前述,PD-1抗体巴替利单抗也在2021年撤销了宫颈癌的上市申请。
4. Amcenestrant治疗乳腺癌的II期研究
3月14日,赛诺菲公布了amcenestrant治疗ER+/HER2-局部晚期或转移性乳腺癌的II期临床研究的最新结果。结果表明AMEERA-3试验未能达到改善无进展生存期(PFS)的主要终点,赛诺菲表示将继续评估AMEERA-3试验的数据,并与研究者合作发表完整结果。正在进行的amcenestrant其他临床试验项目按计划继续进行,包括AMEERA-5(联合帕博西利作为ER +/HER2-转移性乳腺癌患者的一线治疗试验)和AMEERA-6(联合他莫西芬作为因治疗相关毒性而停止芳香化酶抑制剂治疗HR +早期乳腺癌患者的辅助治疗试验)。
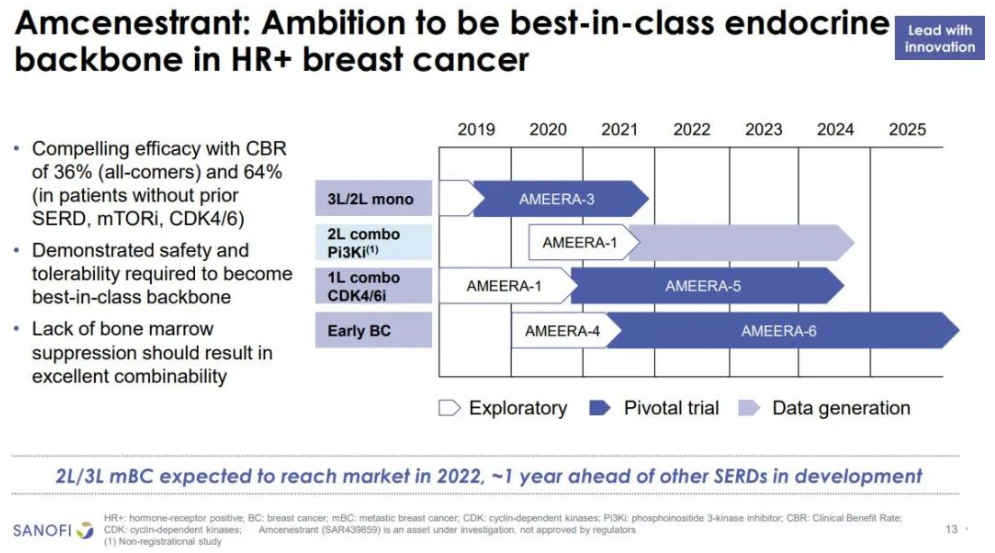
Amcenestrant是一种口服选择性雌激素受体降解剂(SERD),通过与乳腺癌细胞表面的雌激素受体(ER)结合,基于泛素化机制诱导降解,从而降低雌激素受体水平,抑制癌细胞的生长。AMEERA-3是一项随机、开放标签、II期临床试验,旨在评估amcenestrant单药治疗vs医生选择的单药内分泌治疗(包括氟维司群、阿那曲唑、来曲唑、依西美坦以及他莫昔芬)在既往接受过激素治疗的ER+/HER2-局部晚期或转移性乳腺癌患者中疗效和安全性。研究的主要终点是由独立中心审查评估的PFS,研究的次要终点包括总生存期(OS)、客观缓解率(ORR)、疾病控制率(DCR)、临床获益率(CBR)、缓解持续时间(DoR)以及安全性和生活质量评估。
Amcenestrant是首个在关键临床中披露阴性数据的口服SERD,全球目前批准上市的SERD药物只有氟维司群注射液一种,进入III期临床口服SERD药物有6款。艾拉司群是第一个在关键试验中战胜氟维司群的口服SERD,但全人群中mPFS延长不足1个月,OS数据尚未成熟,目前而言在OS数据上并没有显著优势。可以说,口服SERD在与氟维司群的竞争中尚未表现绝对优势,罗氏和阿斯利康也将在2022年披露关键临床数据,每日口服的SERD与每月注射一次的氟维司群最终结局如何,也是看点十足。
5. PF-06425090预防艰难梭菌感染的III期研究
3月1日,辉瑞公布了艰难梭菌 (C. difficile或 CDI) 候选疫苗PF-06425090的关键III期研究 CLOVER 试验结果,数据显示该研究未达到其预先指定的预防原发性 CDI 的主要终点。不过,次要终点的初步分析表明,在降低 CDI 严重程度方面疫苗表现出有利的益处。尽管如此,辉瑞当日股价仍然出现微幅下滑。
CDI 是一种有害细菌,会导致严重的结肠炎症和腹泻,有时可能是致命的。除bezlotoxumab外,近10年尚未有创新性疗法上市。据美国疾病控制与预防中心 (CDC) 报道,美国每年约有 50 万患者感染这种细菌。CLOVER 是一项全球、随机、安慰剂对照的III期研究,旨在评估艰难梭菌疫苗在 50 岁及以上成人中的有效性、安全性和耐受性,试验的参与者在 0、1 和 6 个月时随机接受三剂艰难梭菌疫苗(n=8,766)或安慰剂(n=8,769)。CLOVER 的两个主要疗效终点是完成第三剂后≥14 天的 CDI 首次主要发作和完成第二剂后≥14 天的 CDI 首次主要发作。主要安全终点包括局部反应、全身事件、不良事件和系列不良事件。
由于疫苗未能达到其主要终点,辉瑞表示目前正在重新评估其针对CDI的疫苗计划。同期,Finch Therapeutics公司正在进行的CP101治疗CDI的III期PRISM4研究被FDA按下暂停键,致使其股价下跌超过20%。去年12月,Summit Therapeutics也曾宣布Ridinilazole治疗艰难梭菌感染的临床III期研究(Ri-CoDIFy)失败,因未达到研究的主要优势终点导致当日股价下跌48%。
6. 治疗和预防新冠感染的多项研究
3月31日,InflaRx NV宣布其FIC的单克隆抗人补体因子C5a抗体药物Vilobelimab在针对机械通气 COVID-19 患者的 II/III 期 PANAMO 研究的 III 期数据,显示相对28天全因死亡率降低了 23.9%(Vilobelimab vs 安慰剂=31.7% vs 41.6%,p=0.094)。然而,使用最终统计分析计划中预先指定的回归分析后,数据没有显示统计学意义。
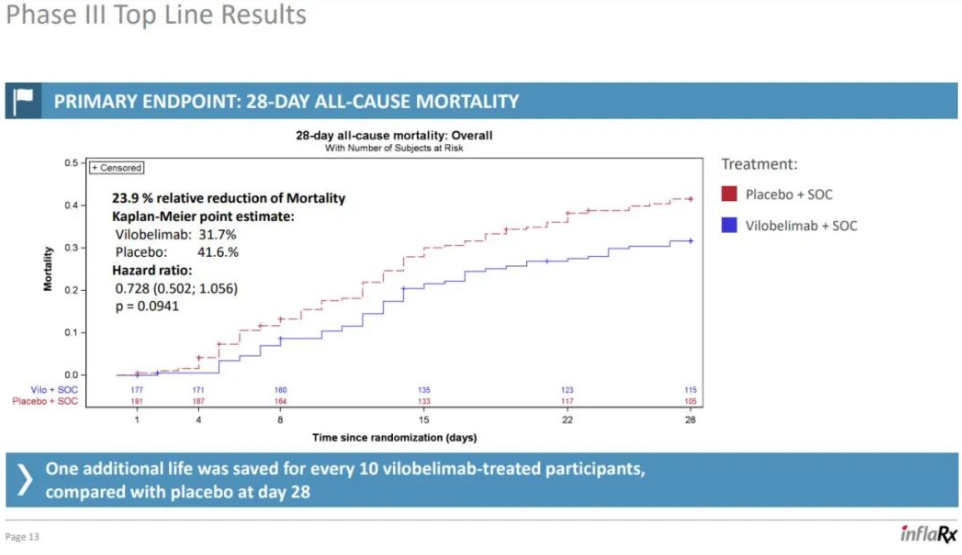
PANAMO研究是一项随机、双盲、安慰剂对照的 III 期部分,随机纳入了欧盟、南美和其他地区的369名机械通气 COVID-19 患者,患者按 1:1 随机分配接受 vilobelimab 或安慰剂,两组都接受包括类固醇在内的标准护理。Vilobelimab是一种补体因子C5a抗体药物,但却不是首个失利药物。去年7月,Innate Pharma的C5aR1抗体Avdoralimab在治疗 COVID-19重症肺炎的Ⅱ期临床试验(FORCE)设置的三个队列中,均未达到研究主要终点。
本月,Vilobelimab也不是COVID-19领域唯一的失利药物。ARCA biopharma同日也公布了 rNAPc2治疗COVID-19 的ASPEN-COVID-19临床IIb期试验结果。临床试验中,两种剂量下均未达到主要疗效终点的统计学意义。在盘后交易中,ARCA股价下跌近28%。
rNAPc2是一种小型重组蛋白,正在开发作为COVID-19和其他病毒性疾病的潜在治疗方法。rNAPc2作为高效、选择性的组织因子 (TF) 抑制剂,已被确定在病毒感染的炎症反应和病毒传播过程中发挥核心作用。其独特的作用机制使 rNAPc2 具有抗凝血、抗炎和潜在的抗病毒特性,因此被认为能够有效地解决来自多种途径的病毒感染。
Avdoralimab和rNAPc2是本月明确宣布未达主要终点的COVID-19疗法药物,除此之外,Icosavax也发布了其 COVID-19 疫苗 IVX-411的I/II期试验数据。尽管表述委婉,仅称免疫反应低于预期,但不难看出研究失败;同时,临床实验数据还表现出与Icosavax VLP技术上的已知数据不一致,公司已经展开相关调查,此消息导致Icosavax股价下跌约70%。
另外,Capricor Therapeutics公布的CAP-1002 治疗 COVID-19 的II期INSPIRE 试验数据显示,CAP-1002未达到安全性的主要终点,股价同样下跌超过30%。
7. 两款反义疗法药物折戟沉沙
3月22日,专注于开发新的疗法来解决病毒和肝脏疾病未满足医疗需求的Aligos Therapeutics宣布,停止开发其候选药物ALG-020572。终止开发的原因主要是因为在 ALG-020572-401研究中,一名慢性乙型肝炎(CHB)受试者在多次给药 210 mg ALG-020572后出现严重不良事件 (SAE),导致丙氨酸氨基转移酶 (ALT) 显著增加并短暂住院。这名患者是该队列中四名CHB受试者之一,可能经历了与药物相关的ALT突然发作,提示药物引起了肝毒性。

ALG-020572是一种 GalNAc缀合的反义寡核苷酸(ASO),同时也是Aligos在2022年终止的第2款药物。1月,Aligos Therapeutics宣布停止进一步开发慢性乙型肝炎 (CHB)的候选药物 ALG-010133,该药物是一种新型化学优化的聚-AC寡核苷酸类似物,与核酸聚合物(NAP)具有结构相似性,能够抑制病毒S抗原转运的寡核苷酸聚合物(STOP)。Aligos表示,停止两个临床开发项目(ALG-010133和ALG-020572)所节省的资金,以及Aligos的合作活动和其他成本节约措施产生的收益能够继续保障至 2024 年上半年的计划运营。
3月28日,渤健和Ionis Pharmaceuticals宣布BIIB078 (IONIS-C9Rx),一种用于 C9orf72 相关肌萎缩侧索硬化症 (ALS) 的研究性反义寡核苷酸,没有显示出临床益处,相关临床研究将被终止。
C9orf72相关 ALS 是一种复杂的ALS遗传形式,科学界认为C9orf72基因导致疾病的机制有多种。BIIB078的设计基于C9orf72相关ALS的疾病机制是由与含有RNA和相应二肽的重复序列相关的毒性假设。不幸的是,这项I期研究并没有支持这一假设,表明疾病机制要复杂得多。
渤健专注于神经系统疾病,曾在这一领域不俗的商业成绩,却也面临流年不利。2021年,渤健有多款药物宣布研究失利,阿尔茨海默病药物阿杜卡尼单抗(Aduhelm) 获得FDA加速批准,但受到广泛质疑。FDA重启了审批调查,也调整了Aduhelm相关适应症,仍遭受医生和保险机构抵制,2021年上市半年,销量额仅160万美元。近期,渤健宣布已经向FDA提交其确认性 IV 期ENVISION试验的最终研究方案后并等待批准,该研究预计将在4年的加速时间内完成。
8. 改良型新药突击之路困难重重
3月初,NuCana plc宣布收到独立数据监测委员会审查结论,NUC-1031(NuTide121)治疗晚期胆道癌与标准护理(吉西他滨加顺铂)相比,不太可能实现将总生存期提高 2.2 个月或更长时间的主要目标,治疗并未带来总体生存获益。盘后NuCana股价开始下跌,并持续多日。
NUC-1031是采用NuCana 公司ProTide 技术针对吉西他滨开展的改良型新药。ProTide技术的关键在于采用保护活化核苷酸类似物的芳基、酯和氨基酸基团(氨基磷酸酯基序)的特定组合。针对不同的药物,测试不同的化合物组合,以确定每个潜在核苷类似物的最佳氨基磷酸酯基序。ProTide 技术由McGuigan 教授发明,并在吉利德的索磷布韦和富马酸替诺福韦艾拉酚胺药物上完成验证。
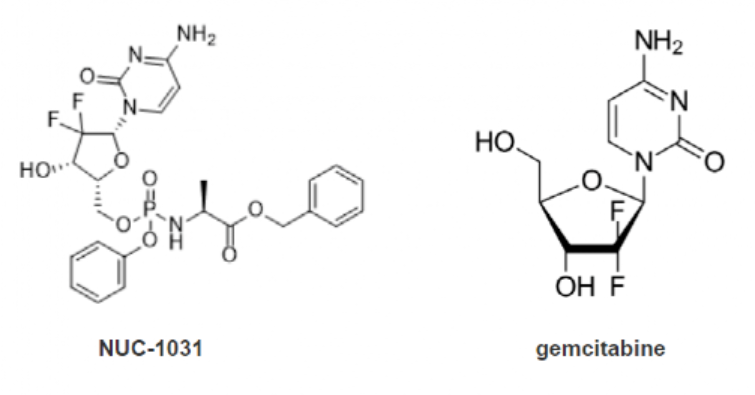
NUC-1031之外,NuCana公司基于ProTide技术仍在开发NUC-3373和NUC-7738。其中,NUC-3373,将在今年晚些时候开始一项针对结直肠癌的III期研究;NUC-7738 将在今年晚些时候进入实体瘤和淋巴瘤患者的II期开发阶段。
NUC-1031之外,另一款改良型新药也在3月公布不利消息。21日,Tonix Pharmaceuticals宣布,正如此前已经公布的中期分析结果预期,与安慰剂相比,TNX-102 SL(盐酸环苯扎林舌下含片)在III期RALLY研究中与安慰剂相比,在第 14 周减少纤维肌痛 (FM) 每日疼痛的主要终点没有达到统计学意义 (p=0.115) 。
Tonix于2021年7月报告了RALLY的中期分析结果,当时独立数据监测委员会基于太可能在计划的完整样本主要终点上取得成功建议停止该研究。Tonix公司停止了新参与者的招募,但同时选择继续让当时的参与者完成研究。
Vallon Pharmaceuticals在3月份也公布改良型右旋安非他明(右苯丙胺)防滥用配方ADAIR用于治疗注意力缺陷多动障碍(ADHD)的疗效结果。数据显示,该研究未达到主要终点。受此消息影响,Vallon公司股价也大跌近70%。
9. Imsidolimab治疗中度至重度痤疮的II期研究
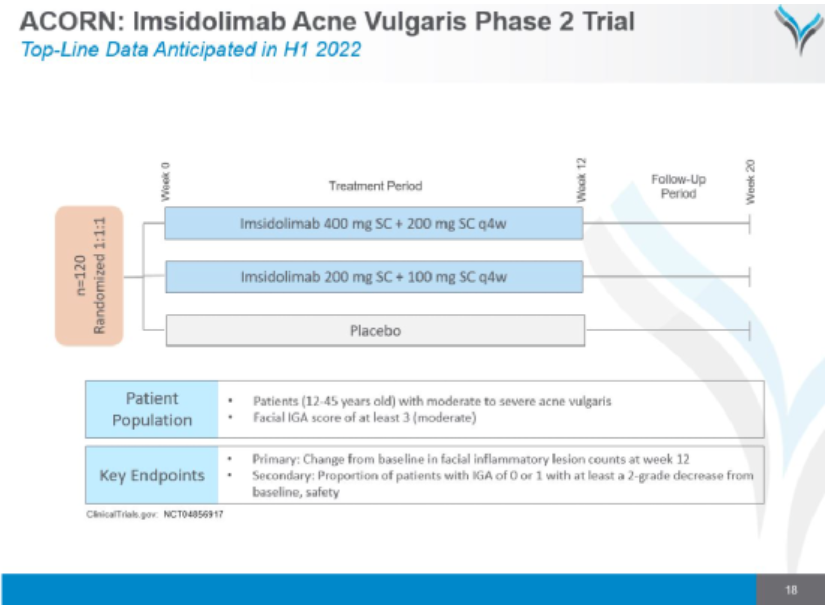
3月14日,AnaptysBio宣布其Imsidolimab用于治疗中度至重度痤疮的II期临床ACORN试验的并未证明在一线主要或次要终点方面未显示出优于安慰剂的改善。Imsidolimab(ANB019)是一种抑制白细胞介素36受体或IL-36R功能的抗体,仍在计划开发用于治疗泛发性脓疱型银屑病(GPP)患者和中度至重度化脓性汗腺炎。
123名中度至重度痤疮患者在位于美国的15个地点参加了ACORN试验,imsidolimab高剂量组患者在第1天接受 400mg 皮下诱导剂量治疗,然后在第4周和第8周每月接受200mg皮下剂量治疗,而 imsidolimab低剂量组患者接受200mg皮下诱导剂量和每月100mg皮下剂量治疗。该试验的主要终点是第12周时面部炎症病变计数相对于基线的平均变化。
去年3月,Imsidolimab在治疗中度至重度掌跖脓疱病的II期临床试验(POPLAR)中,同样未能达到其主要终点。当时受消息影响,AnaptysBio的股价就曾跌幅超过30%,今年3月失利消息接踵而来再次拉低AnaptysBio走势(-10%)。
10. Keytruda联合PARP抑制剂的III期研究
3月15日,默沙东宣布将终止PD-1抑制剂Keytruda联合PARP抑制剂Lynparza(奥拉帕利) 治疗曾接受化疗和醋酸阿比特龙或恩杂鲁胺治疗后疾病进展转移性去势抵抗性前列腺癌(mCRPC)患者的III期KEYLYNK-010研究。

独立数据监测委员会 (DMC) 审查的中期分析数据显示,与对照组醋酸阿比特龙或恩杂鲁胺相比,Keytruda联合Lynparza并没有在总生存期(OS)方面显示出益处,OS是该研究的双重主要终点之一。该试验的另一个双重主要终点,影像学无进展生存期 (rPFS),在早期的中期分析中进行了评估,与对照组相比也没有表现出改善。相反,与对照组相比,联合用药组3-5级不良事件和药物相关严重不良事件发生率更高。
前列腺癌是男性第二大常见癌症,并且与显著的死亡率相关。3月,Harpoon Therapeutics也宣布计划停止治疗前列腺癌的HPN424的临床开发。消息指出,Harpoon 对HPN424数据进行了仔细和彻底的分析,包括迄今为止的临床结果,基于这些数据决定停止HPN424剂量递增研究。
肿瘤领域,本月ORIC也在完成两项Ib期研究数据的中期分析后,决定停止ORIC-101的开发,原因是治疗并没有表现出足够的临床活性。此外,Silverback Therapeutics基于SBT6050在血清和肿瘤内暴露以及药效学标志物中观察到剂量反应,包括在治疗后从患者收集的组织活检中证明的免疫激活数据,以及SBT6050表现的单药有限抗肿瘤活性和细胞因子相关的不良事件限制与帕博利珠单抗的联合使用等,决定终止免疫刺激偶联药物SBT6050(HER2-TLR8)和SBT6290(Nectin4-TLR8)的临床研究。
非肿瘤领域,Avalo Therapeutics基于AVTX-007缺乏临床疗效信号,也决定终止进一步开发;Revelation Biosciences公布了鼻内给予REVTx-99a用于H3N2 流感预防性治疗的IIb期 RVL-VRL01研究中期统计分析结果,数据显示也未达到其主要疗效终点。

