治疗胆管癌 创新FGFR抑制剂获FDA资格优先
今日,日本大鹏药品(Taiho Pharmaceutical)和旗下Taiho Oncology宣布,美国FDA已经接受futibatinib的新药申请(NDA),用于治疗携带FGFR2局部晚期或转移性胆管癌治疗患者(包括基因融合)。Futibatinib是强选择性不可逆不可逆FGFR1、2、3、4口服小分子抑制剂。FDA同时,该申请将获得优先审查资格,预计将于今年9月30日前作出回复。
胆管癌包括肝内胆管癌和肝外胆管癌,通常发生在老年人身上。目前,胆管癌的主要治疗方法是手术切除。然而,胆管癌早期没有明显症状,大多数患者在诊断时已经失去了手术机会。局部晚期和转移性胆管癌不能通过手术完全切除。目前的标准治疗方法主要是化疗、放疗和肝移植,患者预后不良。肝内胆管癌5年生存率仅为9%,亚洲人发病率较高。
Futibatinib通过与FGFR1-4的ATP结合口袋不可逆共价,抑制FGFR介导的信号传导减少携带FGFR1-4肿瘤细胞增殖的基因变异。它已经获得了。FDA治疗胆管癌的突破性治疗认定和孤儿药资格。
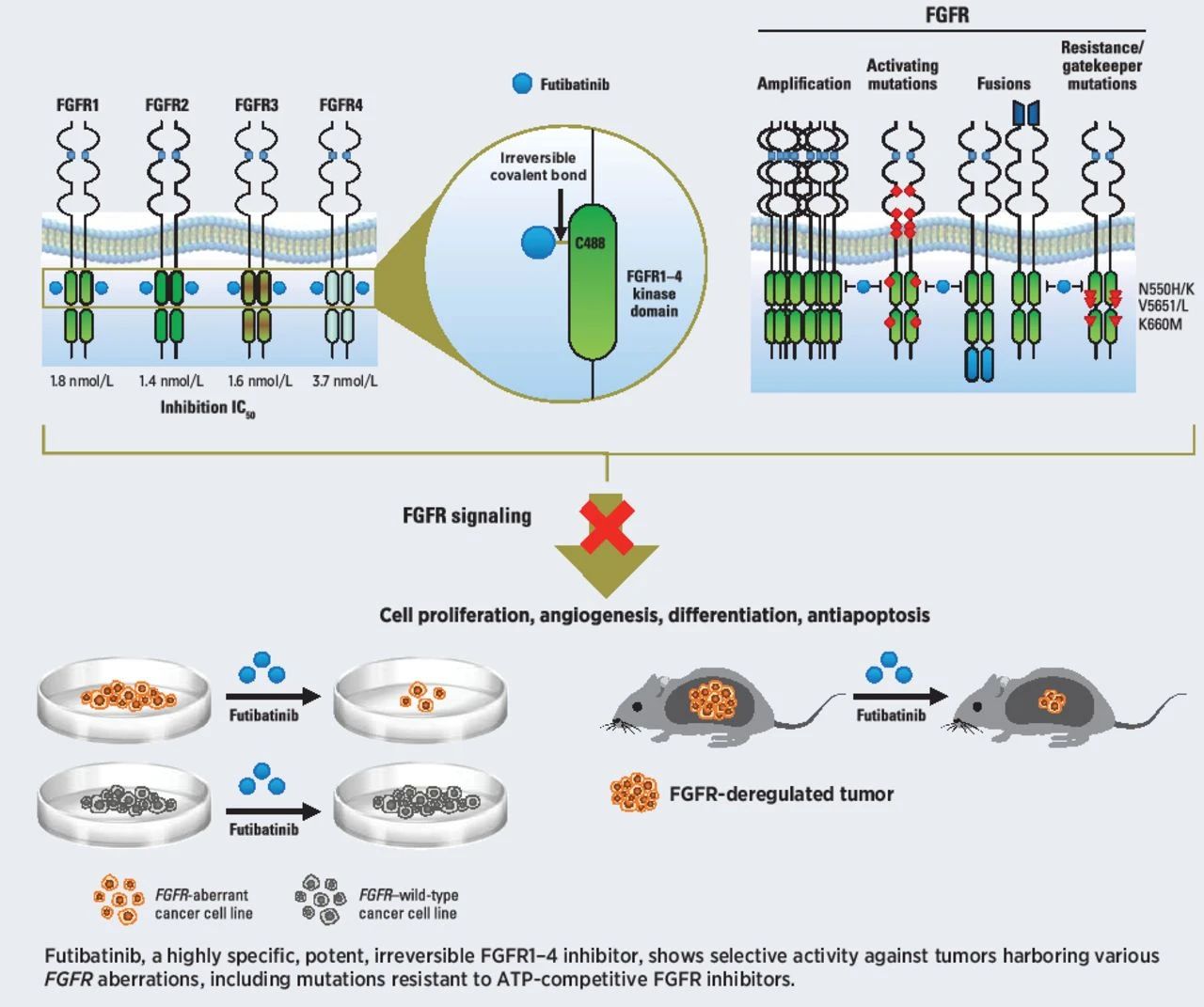
▲Futibatinib作用机制示意图(图片来源:参考资料[2])
这个申请是基于关键性的2b103名患者接受了期临床试验数据futibatinib治疗。临床试验的主要终点是客观缓解率(ORR),futibatinib的ORR为41.7%,关键次要终点是缓解持续时间(DOR),futibatinib的中位DOR为9.772%的患者在几个月内得到缓解DOR超过6个月。
这是我们的向将futibatinib为需要新治疗选择的患者带来重要一步。Taiho Pharmaceutical高级董事总经理Teruhiro Utsugi先生说。
参考资料:
[1] U.S. Food and Drug Administration (FDA) Accepts for Priority Review Taiho Oncology's New Drug Application for Futibatinib for Cholangiocarcinoma. Retrieved March 30,2022,from https://www.prnewswire.com/news-releases/us-food-and-drug-administration-fda-accepts-for-priority-review-taiho-oncologys-new-drug-application-for-futibatinib-for-cholangiocarcinoma-301513278.html
[2] Sootome et al.,(2020). Futibatinib Is a Novel Irreversible FGFR 1–4 Inhibitor That Shows Selective Antitumor Activity against FGFR-Deregulated Tumors. Cancer Research,DOI: 10.1158/0008-5472.CAN-19-2568
