牵手礼来!信达抗癌药雷莫西尤单抗,LOXO-292中国的商业权益
3月28日,信达生物与礼来制药联合宣布,双方将深化战略合作,就以下事项达成协议:1)信达生物从中国大陆进口、销售、推广和分销?(雷莫西尤单抗)和Retsevmo?(塞普替尼,LOXO-292)获批后独家商业化权利2)授予信达生物享有独家商业化权利Pirtobrutinib(LOXO-305)未来中国大陆商业化权的优先谈判权。
这是信达和礼来第五次携手合作。两家公司的合作始于2015年3月,不仅实现了肿瘤领域的深度合作,而且扩展到糖尿病领域。
在这次合作中,雷莫西尤单抗是2020年全球销售额已超过10亿美元的重型抗癌药物,而雷莫西尤单抗是2020年全球销售额已超过10亿美元的重型抗癌药物。LOXO-292和LOXO-305礼来2019年以约80亿美元收购Loxo Oncology抗癌靶向药物的核心资产潜力无限。
目前,雷莫西尤单抗已获批在中国上市,并有新的适应症在上市申请中;LOX-292上市申请也于去年11月提交,有望在年内获批。
雷莫西尤单抗
近年来,研究表明,抗血管内皮生长因子(VEGF)该通道是参与肿瘤血管生成的重要信号通道,胃癌的靶向治疗也进行了许多尝试。根据现有的研究结果,靶向作用是VEGF药物可以给病人带来生存效益。
希冉择?(雷莫西尤单抗)是一种VEGFR-2特异性结合的全人源IgG1单克隆抗体能有效阻断VEGF-A与VEGFR-2结合,也可以抑制VEGF-C及VEGF-D与VEGFR-2的结合。
在美国,雷莫西尤单抗是FDA化疗后晚期或转移性胃或胃食管结合部首次批准(GEJ)腺癌患者的治疗方案也是FDA第一个批准是晚期肝细胞癌(HCC)病人的生物标记物驱动疗法。此外,据此,根据病人的说法。Insight数据库FDA模块显示,雷莫西尤单抗也被批准为非小细胞肺癌和结直肠癌。
雷莫西尤单抗FDA获批适应症
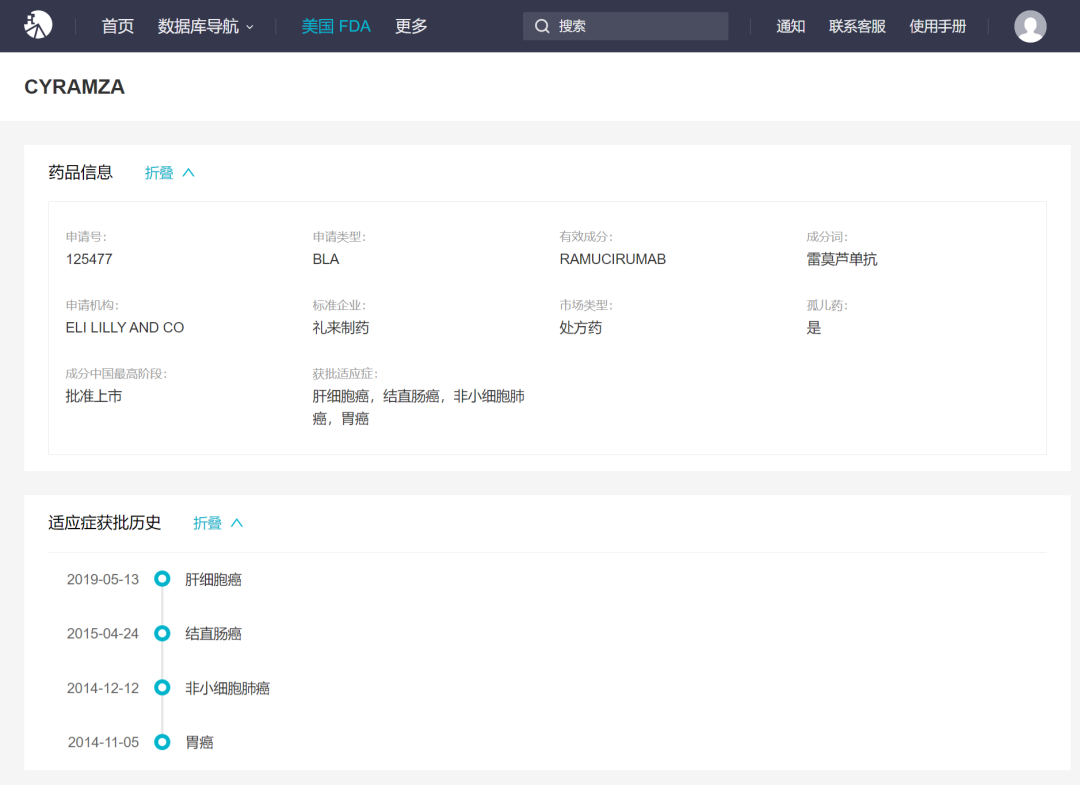
来自:Insight数据库(http://db.dxy.cn/v5/home/)
在中国,雷莫西尤单抗的第一项临床申请早在2010年就提交了,2014年首次启动临床实践,2021年1月接受首次上市申请。
NMPA2022年3月,联合紫杉醇被批准用于治疗含氟尿嘧啶或铂化疗期间或化疗后的晚期胃或胃食管结合部腺癌患者,成为中国第一个也是唯一批准用于晚期胃癌二线治疗的靶向药物;2021年9月,雷莫西尤单抗作为甲胎蛋白(AFP)≥400ng/ml此外,已接受索拉非尼治疗的肝细胞癌患者的新适应症上市申请将于今年内获得批准。
雷莫西尤单抗项目概览
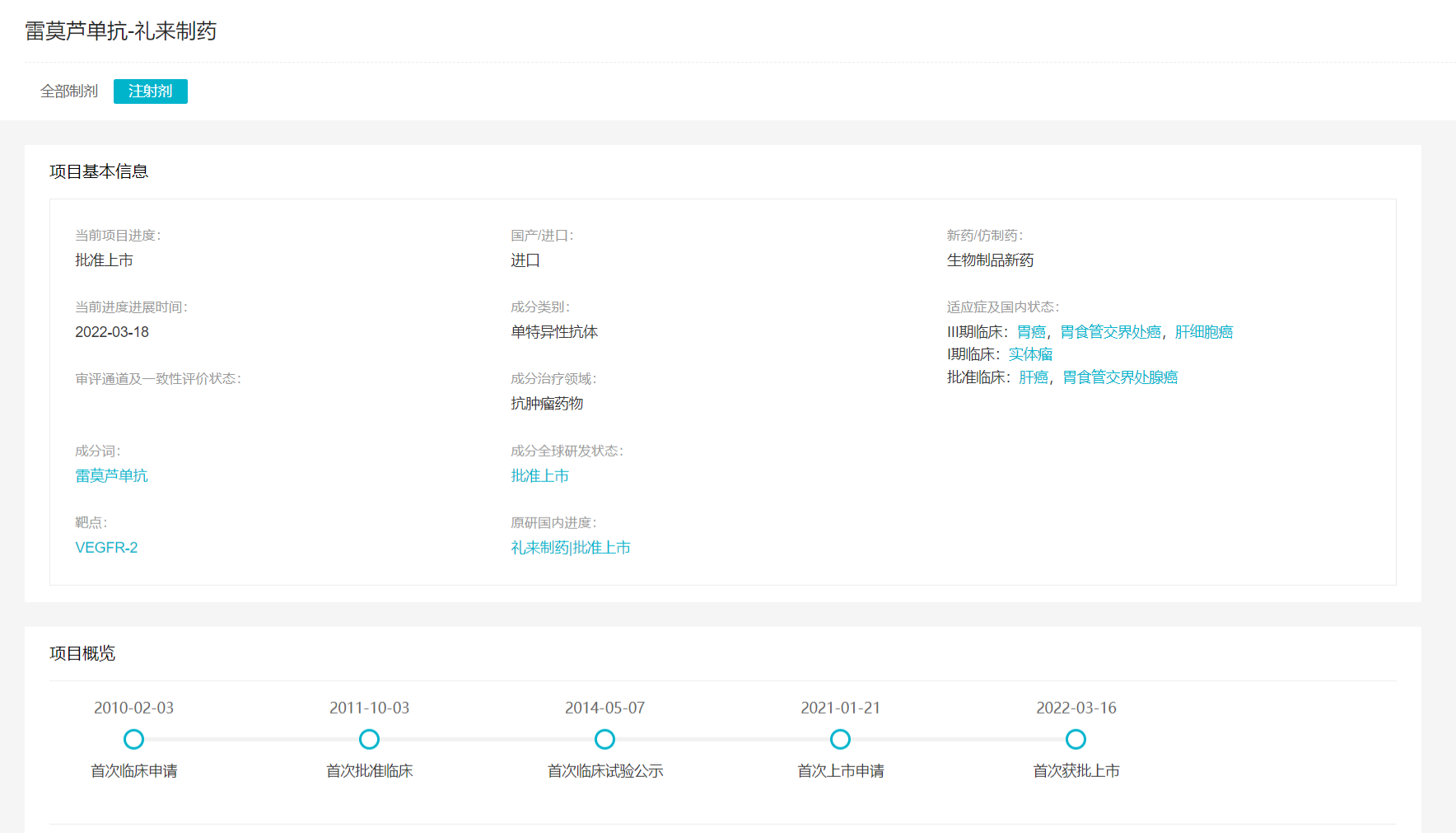
来自:Insight数据库项目进度模块(http://db.dxy.cn/v5/home/)
胃癌和肝癌是中国第三大和第五大癌症,每年约有90万例新病例。大多数患者在现有的一线治疗后会有疾病进展,因此仍有不满足的晚期治疗需求。
据Insight数据库显示,目前国内正在开发科伦、复宏汉霖、正大天晴、齐鲁制药等4个生物类似药物项目。然而,他们仍处于早期研发阶段。
雷莫西尤单抗国内竞争格局
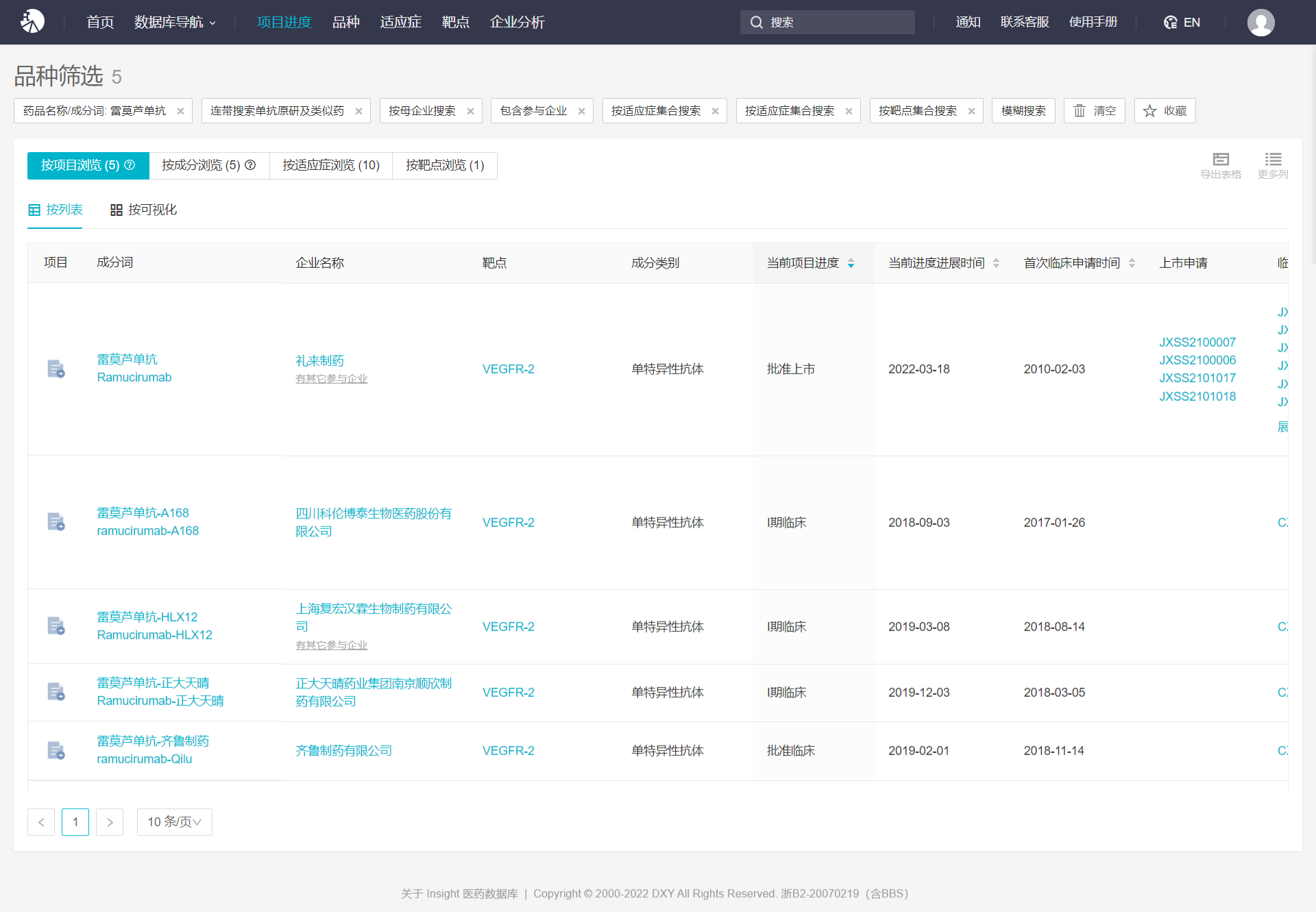
来自:Insight数据库项目进度模块(http://db.dxy.cn/v5/home/)
「泛癌种」抗癌药物:塞普替尼(LOXO-292)
Retsevmo?(塞普替尼,研发代号:LOXO-292)它是一种高选择性、有效的转染重排基因(RET)抑制剂,是FDA第一批专门用于治疗成人转移性RET阳性非小细胞肺癌融合(NSCLC)、晚期或转移性成人和12岁以上儿童需要全身治疗RET突变髓样甲状腺癌(MTC)以及需要全身治疗和放射性碘耐受性(如适当)的晚期或转移性RET治疗阳性甲状腺癌患者。
RET激酶的基因变化,包括融合和激活点突变,导致激酶基因变化,导致激活点突变RET过度活跃和不受控制的细胞生长。RET融合约占2%NSCLC,10-20%甲状腺乳头状癌,Hurthle细胞癌、间变性癌和低分化癌。RET突变约占60%MTC,90%的生殖系MTC。RET阳性癌症与RET突变MTC主要依靠这种单一激活的激酶进行增殖和生存。这种依赖通常被称为「癌基因成瘾」,使肿瘤靶向RET小分子抑制剂高度敏感。
在中国,NMPA2021年8月受理Retsevmo?(塞普替尼)申请上述适应症新药上市,并授予优先审查资格,预计将于今年内获批上市。
LOXO-292项目概览
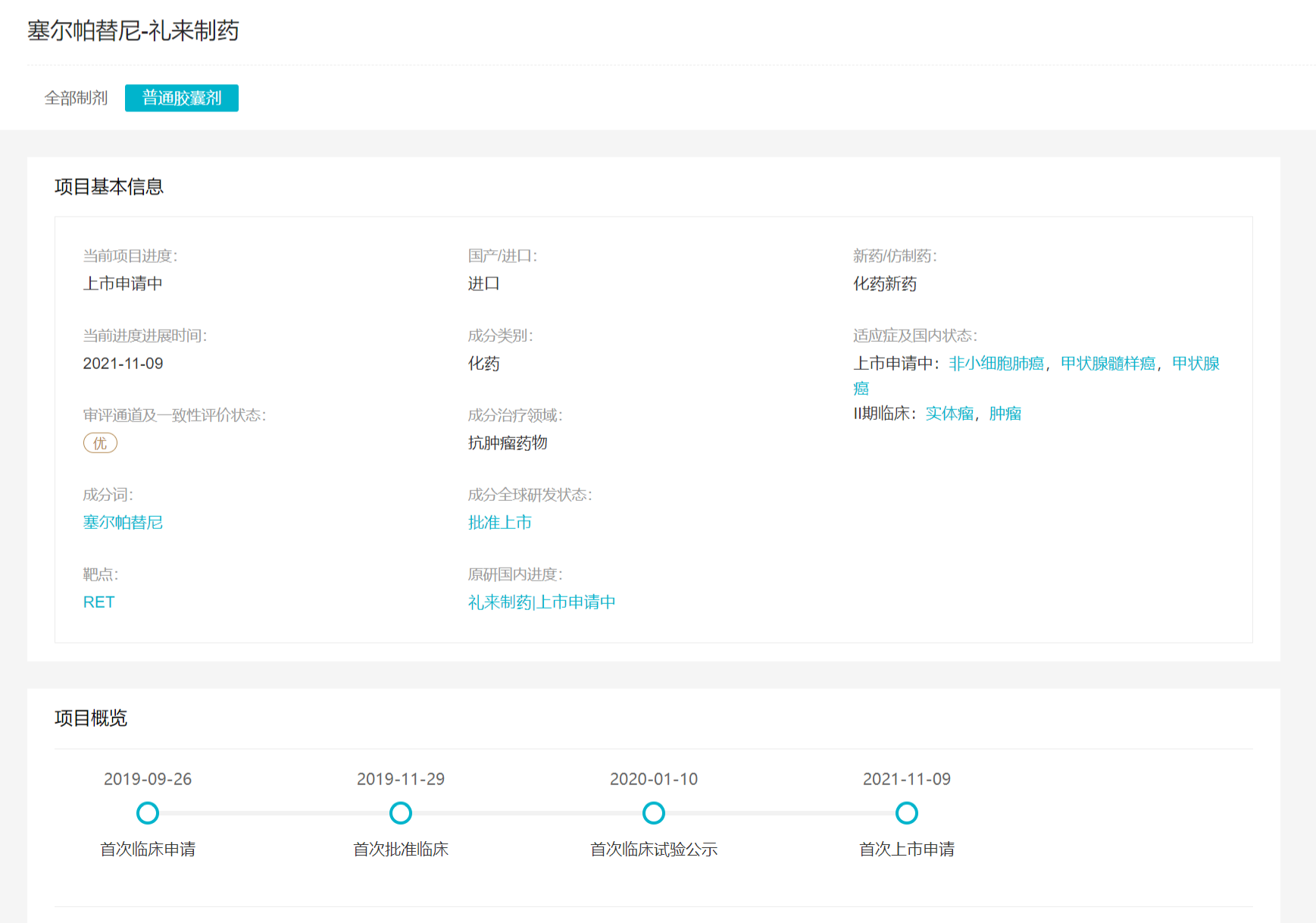
来自:Insight数据库项目进度模块(http://db.dxy.cn/v5/home/)
三代BTK抑制剂LOXO-305:潜在BIC,一挑三PK泽布替尼、伊布替尼、阿卡替尼
在这次合作中,礼来还授予信达生物学Pirtobrutinib中国未来商业权的优先谈判权。Pirtobrutinib(LOXO-305)正在研究的是口服、高选择性、非共价(可逆)布鲁顿酪氨酸激酶(BTK)抑制剂可用于获得性耐药性C481在突变下保持活性,提供持续的高靶向覆盖率,避免其他非共价BTK抑制剂脱靶引起的并发症。2021年12月,礼来已向向。FDA滚动提交药品上市申请。
LOXO-305也是针对BTKC481S新一代的突变BTK抑制剂中进展最快的产品之一。礼来对这种新药充满信心。2021年,三项头对头随机高效全球多中心产品启动III在慢性淋巴细胞白血病/小淋巴细胞淋巴瘤淋巴瘤(CLL/SLL)和套细胞淋巴瘤(MCL)上与已上市的BTK伊布替尼抑制剂(Ibrutinib,强生/艾伯维)(Acalabrutinib,阿斯利康)和泽布替尼(Zanubrutinib,百济神州)直接PK。
据Insight数据库显示,BRUINCLL-321和BRUINMCL-321两项头对头临床试验的中国部分也开始了(CTR20212373,CTR20212310)。
202012月,礼来在ASH会议公布LOXO-305全球多中心I/II期临床数据(摘要542)包括323例既往接受过至少两线治疗、疾病进展或不耐受标准治疗的病例CLL/SLL或其他NHL患者。
礼来LOXO-305临床数据已经公布

来自:Insight数据库(http://db.dxy.cn/v5/home/)
结果表明,139例可用于疗效评估CLL/SLL病人,整体效率(ORR)为63%(95%CI:55-71)。其中121例可评估疗效BTK抑制剂治疗失败的患者ORR为62%(95%CI:53-71),随访10个月或更长时间ORR上升到84%(21/25)。随着时间的推移,缓解的程度增加。以前使用过共价的共价。BTK抑制剂因疾病进展而终止治疗,并因毒性或其他原因终止共价BTK在抑制剂治疗的患者中,ORR相似性。
根据协议安排,待希冉选择?(雷莫西尤单抗)肝细胞癌适应症及肝细胞癌适应症Retsevmo?(塞普替尼)非小细胞肺癌适应症注册后,信达生物将支付4500万$的首付款。信达生物将完全负责这两种产品的定价、进口、营销、分销和销售推广。
信达生物拥有20多个强大的抗肿瘤管道,行业领先的临床开发和注册专业团队,广泛的商业渠道覆盖和3000多个商业团队,在中国成功推出和销售达伯舒(信迪利单抗)和达伯华?(利妥昔单抗生物类似物)。
注:原文已被删除
