病人病情严重程度降低至少75% 礼来IL-13抗体三期临床结果积极
日前,礼来(Eli Lilly and Company)宣布,它正在研究中IL-13抑制剂lebrikizumab作为一种单一的药物治疗方法,在重度特应性皮炎患者的三个关键临床试验中取得了积极的结果。经过16周的治疗,超过50%的患者的严重程度至少降低了75%(EASI-75)。而且,lebrikizumab同时,对瘙痒等重要患者的报告结果具有临床意义。
特异性皮炎是一种由皮肤屏障功能障碍和免疫反应障碍引起的慢性炎症性皮肤病。通常患者会出现强烈、持续的瘙痒症状,以及皮肤干燥、皮肤炎症等,并可能影响睡眠、日常活动和社会关系。在特应性皮炎患者中,白介素13(IL-13)蛋白质过度表达,促进2型辅助T细胞(Th2)反应,驱动炎症,导致皮肤屏障功能障碍。
Lebrikizumab它是一种创新的单克隆抗体药物,具有高亲和力、高特异性的结合IL-13,从而防止IL-13Rα1/IL-4Rα复合体的形成抑制了受体复合体介导的信号通路。lebrikizumab已获得美国FDA快速通道资格,治疗中重度特异性皮炎成人及青少年患者。
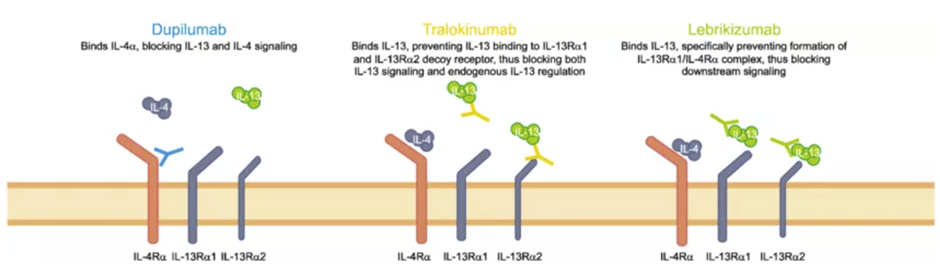
▲Lebrikizumab和其它靶向IL-4,IL-13抗体疗法的作用机制(图片来源:参考资料[2])
在名为ADvocate 1的研究,接受lebrikizumab43%的患者在16周内达到皮肤光洁或几乎光洁标准(IGA),13%的安慰剂患者达到了这一标准。lebrikizumab59%的患者接受了治疗EASI-75安慰剂组为16%。
在ADvocate 2研究,服用lebrikizumab33%的患者在16周内皮肤光滑或几乎光滑,而安慰剂组为11%。在接受的情况下。lebrikizumab51%的患者接受了治疗EASI-75安慰剂组为18%。
礼来全球免疫学和医疗事务副总裁Lotus Mallbris医生说:患者与自身免疫性疾病斗争的经历促进了我们在礼来追求创新、科学和有意义的治疗方法,使他们的生活更好,特别是在那些满足需求的领域。这些数据进一步验证了我们三个更广泛的开发项目的积极结果,我们相信lebrikizumab代表治疗特应性皮炎的新一代生物制品。
参考资料:
[1] Majority of Patients Treated with Lebrikizumab Achieved Skin Clearance in Lilly's Pivotal Phase 3 Atopic Dermatitis Studies. Retrieved March 28,2022,from https://investor.lilly.com/news-releases/news-release-details/majority-patients-treated-lebrikizumab-achieved-skin-clearance
[2] Moyle et al.,(2019). Understanding the immune landscape in atopic dermatitis: The era of biologics and emerging therapeutic approaches. Experimental Dermatology,https://doi.org/10.1111/exd.13911
