新药从研发到上市的全过程:IND、NDA、ANDA傻傻分不清?
10每年花费10亿美元开发一种新药,无论是利益驱动还是拯救成千上万患者的成就感,制药公司的行为都值得我们尊重。
从研发到上市,一种新药需要经过哪些过程?每一步都有哪些经验可以借鉴?本文以小分子药物为例,尝试梳理,希望对大家有所帮助。
1
临床前研究
1.研发(一般 2-3年)
实验室研究,寻找治疗特定疾病的潜在新化合物。
药物靶点的发现和确认
这是所有工作的起点。只有确定了目标,所有后续工作才能有基础。
化合物的筛选与合成
根据靶点的空间结构,从虚拟化合物库中筛选出一系列可匹配的分子结构,合成这些化合物,称为主导化合物。
验证和优化活性化合物
并非所有主导化合物都能满足要求。在这个阶段,需要通过体外细胞试验进行验证,初步筛选出活性高、毒性低的化合物,并根据结构关系进行结构优化。这些化合物被称为药物候选人。
还有一个化合物对目标 A 靶点不起作用,但可能对其他 有影响B 靶点、C 靶点有很好的活性,暂。
2.临床前实验(一般 2-4年)
本阶段的目的是评价药物的药理和毒理作用、药物的吸收、分布、代谢和排泄(ADME)。二是研究生产工艺、质量控制、稳定性等(CMC)。
第一部分的实验需要在动物层面进行,细胞实验的结果有时与活动动物实验的结果有很大的不同。这一步的目的是确定药物的有效性和安全性。
第二部分需要满足GMP完成所需车间。
药理学研究
包括:药效学、药动学
毒理学研究
急毒、长毒、生殖毒性、致癌、致畸、突变
制剂的开发
如果你不能得到一些化合物,你可以直接把它们倒进嘴里。制剂开发是药物应用的重要组成部分。比如有些药物口服吸收差,需要开发成注射剂。
有些药物在胃酸中会失去活性,需要开发成肠溶剂。
有些化合物溶解性差,这也可以通过制剂部分解决。
有的需要局部给药,需要通过制剂开发成雾化剂、膏剂等。
2
临床试验审批
Investigational New Drug(IND)
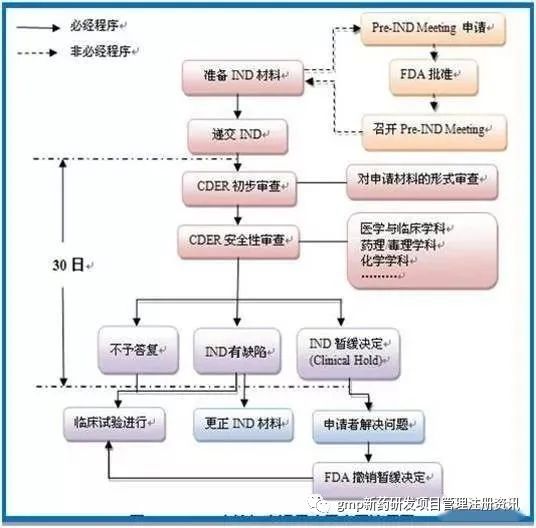
3
临床试验(一般3-7年)
人体试验分为三个阶段:
? Ⅰ期临床 20-100例如,正常人,主要进行安全评价。
? Ⅱ期临床 100-300例如,患者,主要进行有效性评价 。
? Ⅲ期临床 300-5000例如,患者,扩大样本量,进一步评价。
因为Ⅰ-Ⅲ 期临床在整个药物研发过程中非常重要,我们重点介绍这一部分。
在传统意义上,新药的临床研究分为I/II/III期,后来 II 期又分期IIa 和 IIb(很大程度上是因为肿瘤药物的研究),随后出现了 0 期研究的概念(很大程度上也是因为肿瘤药物的研发)。然后有人提出0/I 期为早期临床研究,IIa 是中期临床研究,IIb 和 III 期为晚期临床研究。
事实上,我认为这种分类对我们从两个方面进行临床研究和设计的人来说非常重要:
1. 分期与研究目的有关,不同的目的可分为不同的时期/阶段。
2. 不同时期/阶段的临床研究往往对应于一定的研究框架设计(交叉研究、平行对照、单臂、终点选择等)。
因此,了解不同时期/阶段的临床研究,其意义超出了知道有这样的分法本身。
分期付款的一端是研究目的,另一端是相应的设计框架(当然,这只是一个粗略的框架,许多问题应该根据疾病、药物等来确定)期付款,帮助我们理解,研究目的,一般设计方法和想法,一般如何处理;为什么这样做,各种设计的优缺点。
因此,我们先来看看不同阶段的研究目的。
1.0 期
目的是在满足一定统计要求的前提下,在有限的样本量(通常不超过20)和有限的时间内(每个患者的治疗期通常不超过几周),初步判断研究药物是否有效,剂量是否有效,是否应继续开发,看看一些疗效判断方法是否可行。
从目的上看,0 期研究也是对药物效果的初步判断,类似于 II 期(尤其是IIa),所以 0 期的设计在某些方面类似 IIa 单臂研究,但由于样本量小,必须满足一定的统计要求,也有其特点,设计可能更复杂。
2.I 期
通常是摸索剂量(dose finding,dose-ranging),药代(PK)和药动(PD),样本量不大(一般不超过20,或20左右)。特别是。PD,由于其特点,交叉研究通常用于交叉研究,适合这种设计目的。
在交叉研究中,每个患者都是自己的比较(在不同阶段,分别扮演研究小组和比较小组的角色),交叉研究的变量一般小于平行比较,所以在样本的使用中,交叉研究的效率远高于平行比较,如果交叉研究包括 20例患者,平行比较 50例可能不会得到类似的结果。
然而,交叉比较有许多限制,如脱落和失访对交叉研究的影响远远大于平行比较研究;同一人在不同时期接受不同的治疗,中间间隔洗脱期,导致后遗效应和治疗-时间相互作用等等。因此,在后期的临床研发中,很少看到有用的交叉对照是的,但远低于平行对照)。
3.II 期
II 期是对疗效和安全性的初步判断(事实上,安全贯穿研发),一般称为safety
