赛诺菲抗CD中国临床申报的38抗体皮下注射剂型
转自 | 医药观澜
6月17日,中国国家食品药品监督管理局药品审评中心(CDE)官网最新公示,赛诺菲(Sanofi)递交了isatuximab临床试验申请注射液(皮下注射)。公开资料显示,isatuximab是一款抗CD38单克隆抗体已被许多国家和地区监管机构批准用于静脉注射治疗一些复发性多发性骨髓瘤(MM)患者。
2022年3月,赛诺菲和黑石生命科学(Blackstone Life Sciences)宣布将支付高达3亿欧元的战略合作,以加速评估全球关键研究和临床开发项目isatuximab用于治疗的皮下制剂配方MM病人。在新闻稿中,赛诺菲曾表示,关键研究预计将于2022年下半年开始。
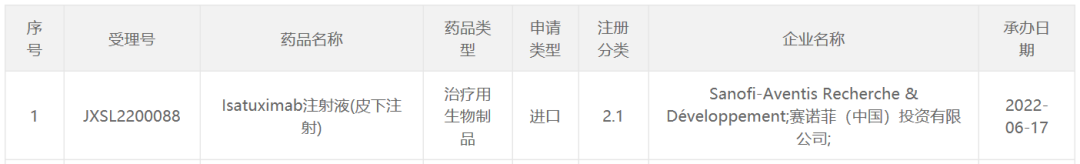
截图来源:CDE官网
Isatuximab它是一种单克隆抗体,可表达在多发性骨髓瘤细胞上CD38特异性受体组合。它通过程序性肿瘤细胞死亡(细胞凋亡)和免疫调节活性等多种机制发挥作用。CD38高度均匀地表达在多发性骨髓瘤细胞表面,使其成为治疗抗体的潜在目标。
在isatuximab在皮下制剂开发方面,赛诺菲此前曾与一家药品交付技术创新公司合作Enable Injections为了促进产品皮下给药的发展,合作的目标是提供一种以患者为中心的独特的治疗体验。与静脉滴注相比,皮下注射可显著缩短给药时间。ClinicalTrials网站,目前,isatuximab在复发/难治性多发性骨髓瘤患者中,皮下制剂正在进行三期临床试验。
此前,isatuximab静脉给药剂型已在海外获得批准(英文商品名称为Sarclisa)。其中,2020年3月获得美国奖FDA与泊马度胺和地塞米松一起批准(pom-dex)联合治疗成人多发性骨髓瘤患者。这些患者至少接受过两种早期治疗,包括来那度胺和蛋白酶体抑制剂。这种药于2021年4月再次获得FDA批准,卡非佐米和地塞米松(Kd)复发/难治性多发性骨髓瘤患者的标准治疗联合治疗,这些患者接受了1-3种早期治疗。
在名为ICARIA-MM三期临床试验,isatuximab与pom-dex与对照组相比,该方案联合使用,将患者的疾病进展和死亡风险降低40%,中位无进展生存期(11).53个月 vs 6.47个月)和总缓解率(60个月).4% vs 35.3%)也有明显的改善。在另一个项目中IKEMA临床试验三期随机双盲和开放标签,isatuximab与Kd标准治疗联合治疗降低了45%的疾病进展或死亡风险,患者处于无进展生存期的中位(PFS)也可以延长。
多发性骨髓瘤是一种由骨髓中的浆细胞癌引起的血液癌。异常的浆细胞聚集在骨髓中,在体内的许多骨骼中产生肿瘤。这些细胞不仅不能发挥正常的功能,而且它们产生的抗体也会导致骨髓不能产生健康的血细胞。癌胞会影响正常血细胞的产生,导致血细胞指数下降、骨损伤和肾损伤。尽管近年来MM治疗取得了许多进展,但大多数都取得了进展MM病人仍然面临着复发或耐药的问题,威胁着病人的生命。
参考资料:
[1]中国国家食品药品监督管理局药品审评中心(CDE)官网. Retrieved Jun 17 ,2022. From https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2] Sanofi announces €300 million collaboration with Blackstone Life Sciences to advance an innovative treatment for multiple myeloma. Retrieved March 15,2022,from https://www.sanofi.com/en/media-room/press-releases/2022/2022-03-15-07-00-00-2403030
[3] FDA approves Sarclisa? (isatuximab) in combination with carfilzomib and dexamethasone for patients with relapsed or refractory multiple myeloma. Retrieved March 31,2021,from https://www.globenewswire.com/news-release20101/00/1/2/1/2/1/2/1/2/1/2/1/2/1/2/1/2/1/2/2/2/2/2/2/1/1/1/1/2/1/1/1/2/1/1/2/1/1/2/1/2/1/2/1/1/2/1/1/2/1/1/2/1/1/2/1/2/1/1/1/2/1/1/2/1/1/2/1/1/2/1/1/2/1/1/2/1/1/1/2/1/1/2/1/1/2/1/1/2/1/1/2/1/1/1/2/1/1/1/1/2/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1en/FDA-approves-Sarclisa-isatuximab-in-combination-with-carfilzomib-and-dexamethasone-for-patients-with-relapsed-or-refractory-multiple-myeloma.html
[4] FDA approves Sarclisa? (isatuximab) in combination with carfilzomib and dexamethasone for patients with relapsed or refractory multiple myeloma. Retrieved March 31,2021,from https://www.globenewswire.com/news-release20101/00/1/2/1/2/1/2/1/2/1/2/1/2/1/2/1/2/1/2/2/2/2/2/2/1/1/1/1/2/1/1/1/2/1/1/2/1/1/2/1/2/1/2/1/1/2/1/1/2/1/1/2/1/1/2/1/2/1/1/1/2/1/1/2/1/1/2/1/1/2/1/1/2/1/1/2/1/1/1/2/1/1/2/1/1/2/1/1/2/1/1/2/1/1/1/2/1/1/1/1/2/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1/1en/FDA-approves-Sarclisa-isatuximab-in-combination-with-carfilzomib-and-dexamethasone-for-patients-with-relapsed-or-refractory-multiple-myeloma.html
