ASCO会后感:双特异抗体引领第四波制药行业革命
第58届美国临床肿瘤学会术活动,第58届美国临床肿瘤学会(ASCO)年会设计Bispecifics : Are two better than one?特别专题ASCO历史上首次就三大特异性双抗研究进行专题讨论,业界高度关注。
无独有偶,6月8日全球首个CD20/CD3 T双特异性抗细胞结合Lunsumio(mosunetuzumab)获得欧盟委员会附条件批准的上市再次引起业界对双重抵抗的关注。这两个事件似乎是一个预兆:特异性免疫双重抵抗正面出现。
Are two better than one?ASCO会议专家通过三项研究表达了他们的观点。
双抗临床研究回顾
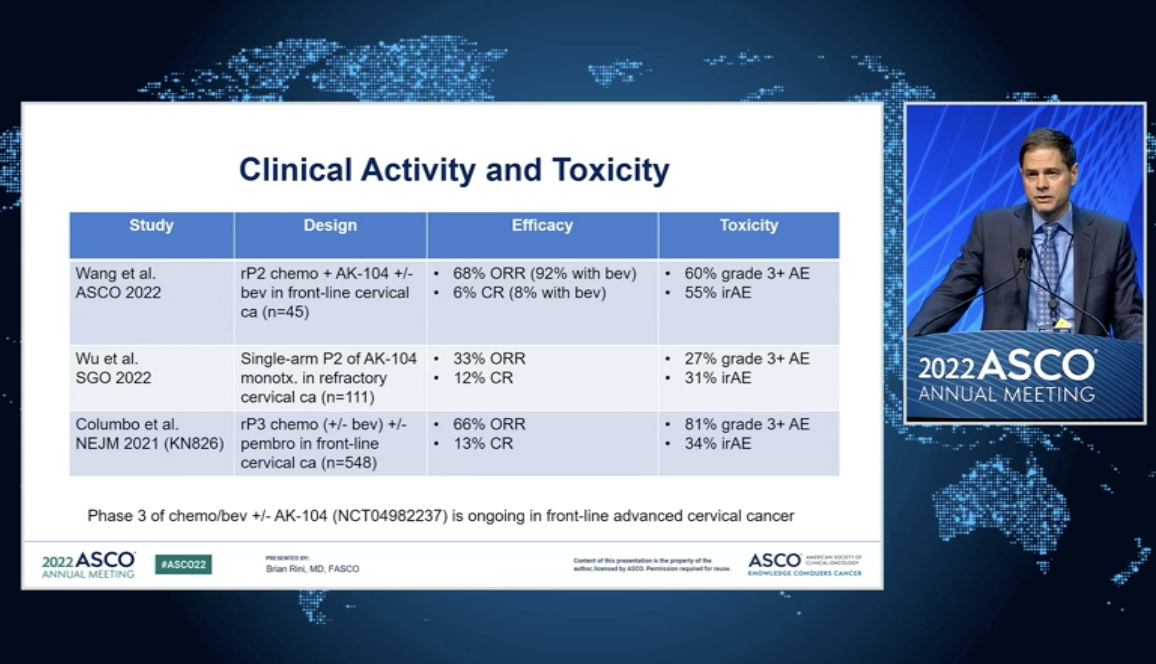
第一项研究来自国内创新生物制药企业康方生物,探索PD-1/CTLA-双抗卡度尼利(AK104)一线治疗复发或转移性宫颈癌的联合标准治疗。结果显示:在10mg/kg不管剂量PD-L1表达与否,AK104联合含铂化疗/-贝伐珠单抗的客观缓解率(ORR)为79.3%;针对CPS≥1的人群,ORR为82.4%;针对CPS<1的人群,ORR为75.0%。≥3级治疗相关不良反应(TRAE)发生率为60.0%。在这项研究中,AK104在二、三线治疗中继续复发性或转移性宫颈癌(R/M CC)中国的优异表现表明其具有全面覆盖R/M CC人群潜力巨大。

第二项研究来自阿斯利康的子公司MedImmune,探索了PD-1/CTLA-4双抗MEDI5752一二线治疗晚期肾细胞癌,是MEDI首次人体试验5752。初步结果显示,MEDI5752一线治疗肾细胞癌可以带来持久的深度肿瘤缓解,750mg和1500mg低剂量效相似,但低剂量耐受性较好。

对于这两个目标PD-1/CTLA-4的研究,Vanderbilt-Ingram癌症中心的Brian I. Rini认为,“PD-1和CTLA-4双特异性阻断具有靶向肿瘤T细胞的理论优势具有特异性、更有效的阻滞力和持久的临床疗效。宫颈癌的早期临床数据证明了双重抗性的安全性和活性。预计随后的研究将继续证明该药物具有更好的效益/风险比。
Brian I. Rini点评
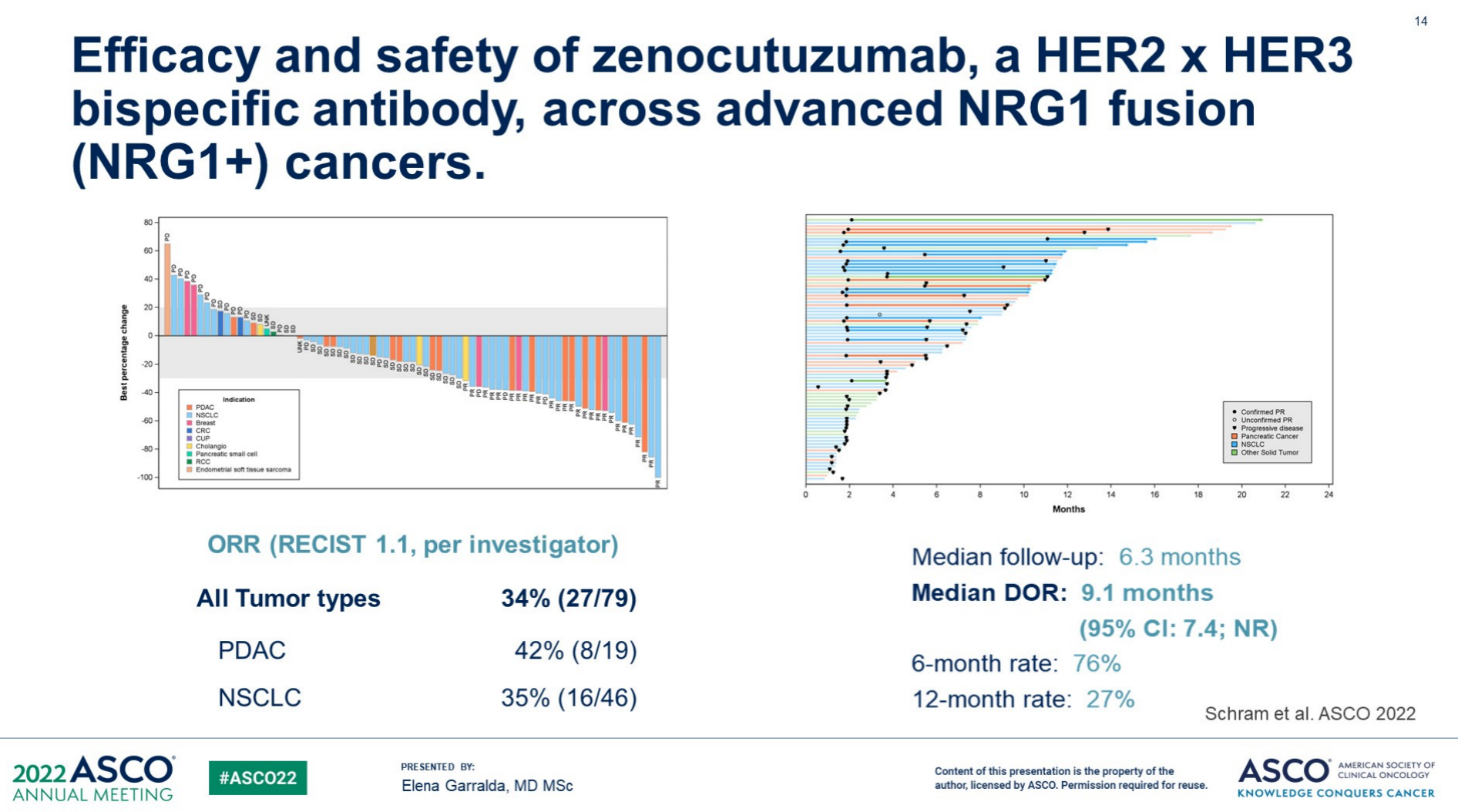
第三项研究来源Merus,探索了HER2/HER3双抗Zenocutuzumab治疗NRG晚期阳性实体瘤。Zenocutuzumab在多种既往经治的晚期NRG1阳性实体瘤显示持续缓解:既往中位治疗线数为2,ORR为34%,中位DoR为9.一个月,具有良好的安全性特征耐受性,有望为NRG阳性实体瘤提供解决方案。Vall d'Hebron肿瘤研究所Elena Garralda新结构带来了新的作用机制,双特性抗体扩大了单抗的可能性。
仅仅基于上述三项研究可能不能解释任何事情,但在生命科学和技术快速变化的创新时代,积极接受技术变化和审视发展趋势可以说是制药人的基本技能。通过回顾现代免疫治疗的发展历史,我们也可以看到一个或两个趋势。
长,试错,耐得住寂寞,PD-肿瘤免疫1.0时代
从1984年首例IL-2.从治疗黑色素瘤患者开始,抗肿瘤治疗领域发生了近乎不可能的变化。虽然它无情地粉碎和重塑了人类对肿瘤与抗肿瘤相互作用的有限认知,但也带来了许多惊喜。
2014年第一款PD-1市场上,通过激活人人类免疫系统,轻松实现了一个世纪的抗癌梦想,大大提高了抗肿瘤的疗效,数十种癌症类型的生存期大大提高了3个~四次,甚至帮助晚期癌症患者实现完全治愈。国内肺癌领域顶尖专家吴一龙曾坦言,PD-1抑制剂的疗效,放在十年前是不敢想的。
近十年来,肿瘤领域创新成果频出,CTLA-4抑制剂、PD-1/PD-L1抑制剂、PD-L1 CTLA-4.双免等疗法相继获批上市。免疫检查点的抑制剂扫肿瘤似乎很容易,但事实上,这条路已经走了20多年。1992年,日本京都大学Tasuku Honjo第一次发现教授PD-1,2014年FDA批准首个PD-1免疫疗法。
由于可及性和研发技术的差异,国内的道路也极其艰难。2018年6月,中国推出了第一款PD-1单抗,使国内免疫治疗可及;同年12月,中国首次自主研发PD-1获批上市。
创新药物的研发是一条不归路。它不仅要求制药企业有前瞻性的判断,而且要承受孤独和无数的尝试和错误。在看似一帆风顺的旅途中,许多孤独的人在历史舞台上沉默了。
即使现在已经成为生物制药巨头BMS,2016年也在肺癌III研究失败了,研究结果公布当天,股票一度下跌20%!在这项研究中O华尔街对药物不如化疗的惨痛失败感到惊讶,O药到底行不行?尽管此前默沙东在肺癌方面的尝试已经大获全胜,BMS是否说明案例PD-一般不适用?
时间给出了答案,研究的失败并没有完全否定O药物,目前在多个肿瘤中的疗效足以证明。作为第一批吃螃蟹的人,BMS推动了中国乃至全球肿瘤免疫治疗时代的到来,O2021年药品销售额达到75亿美元,成为全球TOP三十种药物。这一巨大的成功可能得益于公司对抗肿瘤治疗未来技术趋势的深刻理解和前瞻性判断。
下一代抗体,下一个重型炸弹
纵观发展,O药、K药物的成功,推动PD-1.研发热潮迅速覆盖全球肿瘤治疗领域,但随后PD-1/PD-L单靶向抗体药物(如单抗)本身有许多局限性。越来越多的研究发现,大约80%的患者对此感兴趣PD-1/PD-L1单抗疗效反应不佳或完全无效,PD-1/PD-L1单抗治疗GC、HNSCC、NSCLC、继发性黑色素瘤耐药率分别高达71%、54%、55%、60%,还有>50%的原发性耐药性;还有一个例子CTLA-不能解决单药或联合用药的毒性问题,VEGF肺鳞癌单抗出血风险严重等。
在上述问题暴露于市场之前,科学研究和工业界已经制定了开发新一代药物的计划。在中国,许多抗肿瘤治疗方法都在中国PD-1当单抗成功获批上市时,一批人致力于成为first-in-class肿瘤免疫药物正在悄然兴起。例如,康方生物已申请上市,预计今年将获得批准PD-1/CTLA-4双抗AK104等等。
谁将领导下一代肿瘤治疗的传奇?2020年,美国科学院院士Raymond Deshaies在Nature根据这份文件,双特异性抗体引领了制药革命。

清华大学陈晓媛团队出版Nature Reviews Drug Discovery这份报告证明了这一点:截至2021年7月,细胞疗法在下一代肿瘤药物管道中排名第一,其次是双特异性抗体和多特异性抗体,成为主要肿瘤领域FIC药物管道。
单抗市场的快速崛起和良好的表现,为双重阻力的商业化树立了榜样;全球企业积极投资,进一步推动双重阻力项目的研发进度。一些分析师预测,到2024年,中国双重阻力市场的规模预计将增加到50亿元,到2030年将超过100亿美元。双重阻力引发了新一波制药行业的革命性创新浪潮,这将成为未来抗肿瘤治疗的支柱。
逐一突破,双抗研发引领肿瘤免疫2.0时代
尽管双特异抗体(BsAb)这一概念早在1960年就首次提出,但经过几十年的临床实践,世界上只有6种多特异性抗体获得批准,其中3种用于抗肿瘤治疗。
自2014年以来,已有相当数量的双抗新临床试验注册。据报道,2011-2021年间,全球共有308项BsAb涉及126种药物的相关研究,但超过93种.5%的试验仍然存在I期或II期III上市阶段临床/抗肿瘤治疗BsAb中国自主研发的产品有11种BsAb占4席,康方生物独占2席。目前正在研究双抗的靶点,绝大多数都是经过临床验证的靶点,有望降低双抗研发失败的风险。
无论是肿瘤领域还是非肿瘤领域,从临床价值的角度来看,作为下一代抗体药物的双重抗体药物,其发展应逐一打破以往治疗方案中存在的痛点,包括单靶抗体药物和抗体药物联合治疗无法解决的问题。一些创新的双重抗体也逐渐证实了科学家在项目开发时的想法。
以O Y为例,相比O单药,黑色素瘤联合疗法RCC、NSCLC、SCLC中均体现出ORR优点,但其不良反应较高,以一线黑色素瘤为例,O Y对比O药物和伊匹木单药,3级以上TRAE分别为59% vs 22%vs因毒性不耐受终止治疗的28%,40%vs 13% vs 15%,在CRC和RCC结果相似。
前面提到的PD-1/CTLA-4双抗AK104一线治疗R/M CC其中的数据为例CPS≥1时的ORR达82.4%,无论PD-L1是否表达的ORR达79.3%。已被FDA批准适应症K一线治疗药物CPS≥1的人群中的ORR为68%,且CPS<1时为11.4%。康方生物已于2021年9月提交AK104用于既往系统治疗失败R/M CC预计在2022年准的申请。
除了AK104、双抗解决单抗无法解决的案例还有很多。包括罗氏开发的VEGF/ANGPT2双抗Faricimab,解决了阿柏西普用药间隔问题,潜在疗效较好;强生学发展EGFR/c-MET双抗Amivantamab,解决了EGFR ex20ins突变及EGFR经典突变耐药性问题;康方生物今年ASCO另一种披露的双抗AK112(PD-1/VEGF),它突破了贝伐珠单抗(VEGF)在鳞状NSCLC可能面临可能面临的严重出血风险NSCLC的潜力。
2011年第一个免疫检查点抑制剂CTAL-4单抗被FDA批准上市,到现在很多PD-1单抗百花齐放,PD-1、CTAL-以免疫检查点抑制剂为代表,为当前肿瘤免疫治疗带来繁荣。
由于目前批准的单抗联合单抗免疫联合疗法项目相对较少,成为标准治疗的联合药物也很少,目前很少出现双抗直接治疗PK单抗联合的头对头研究结果。Raymond Deshaies预测,随着更多双免疫检查点新药的批准,肿瘤免疫治疗的新蓝海应运而生。

