3款国产ADC亮相ASCO20229
文丨森林
药物偶联物抗体(antibody-drug conjugates,ADCs)集靶向性和杀伤性于一体,精准制导的魔法子弹威力凸显。自提出这一概念以来,已有100多年的历史。
如今,ADC药物发展迅速,截至目前,全球13种药物已获批上市,有100多种临床活跃药物。
今年6月3日至7日,美国临床肿瘤学会(ASCO)年会将在线与美国芝加哥举行,包括在线会议ADC成为关键焦点。第一、第三个共产党在ADC这个领域展示了它的领先地位ADC明星产品DS-8201将发布多个最新数据,国内将发布ADC荣昌生物、乐普生物和科伦博泰的先驱者也将布ADC最新的产品研究结果,
ASCO2022ADC 产品
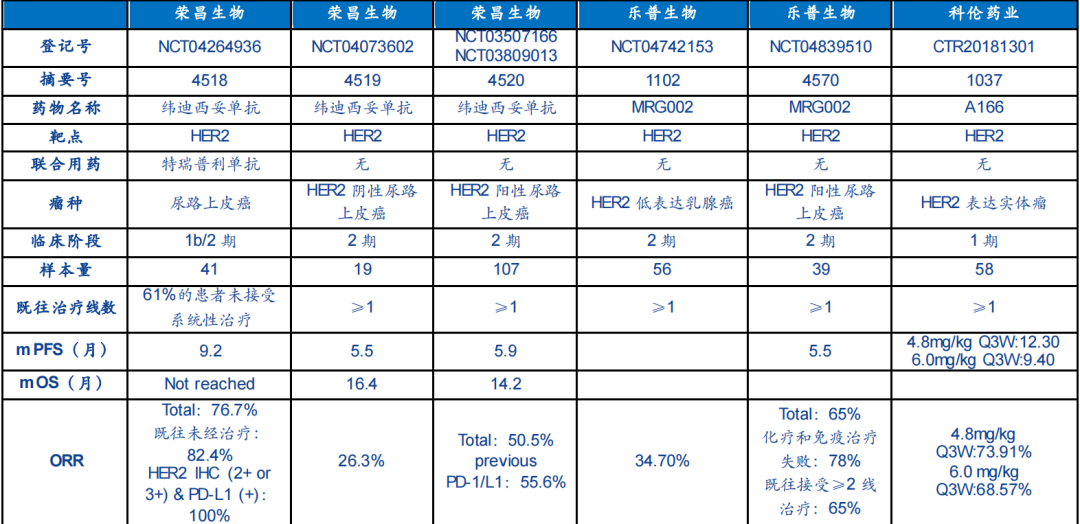
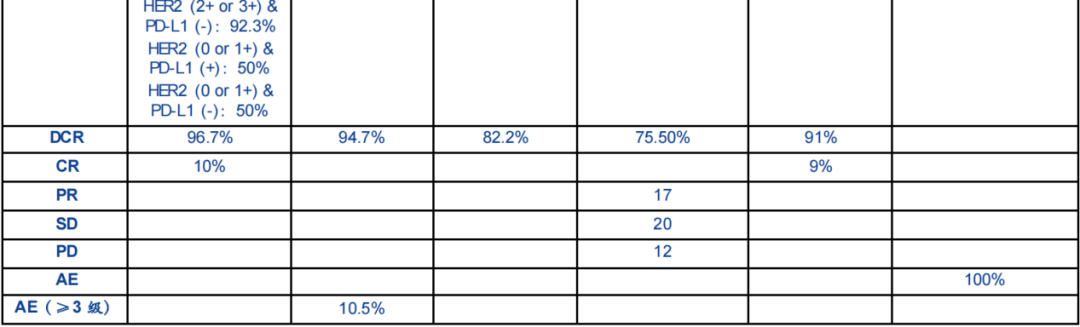
资料来源:ASCO安信证券研究中心2022
ADC明星产品——DS-8201多项研究结果即将公布
ADC通过化学反应,传统的小分子抗癌药物和重组单克隆抗体(mAb)通过连接分子的分子(linker)新分子的组合。一般来说,这些mAbs分子可以特异性识别肿瘤特异性抗原,因此ADC该技术的主要目的是赋予一些传统的小分子抗癌药物主动靶向功能。
2000年,第一个ADC药品上市,但一直不温不火。直到2019年,第三代ADC药物DS-8201问世,打开HER2新的乳腺癌治疗模式。
DS-8201商品名为Enhertu,2019年12月019年12月在美国获得批准,用于治疗三线治疗HER2阳性不能切除或转移HER基于阳性乳腺癌患者。DESTINY-Breast2022年的最新结果V1版NCCN指南已将DS-8201列为HER2阳性,不能切除或复发IV二线治疗乳腺癌的首选。
此外,DS-8201还被批准为局部晚期或转移性HER2阳性胃或胃食管腺癌的适应症和疾病在铂化疗期间或之后的进展HER2.治疗突变性转移性非小细胞肺癌患者的突破性治疗HER2阳性结直肠癌还获得了较好的临床试验数据,可谓抗癌多面手。
值得注意的是,阿斯利康和第一三共此前宣布DS-8201在治疗HER2.不能切除或转移性乳腺癌患者的低表达III期临床试验DESTINY-Breast与化疗相比,04研究DS-8201显著延长了此类患者的无进展生存期和总生存期。这次会议(全面讨论,LBA#3)这项研究的详细数据将公布,预计测试结果将发生变化HER2低表达乳腺癌的治疗模式。
此外,DS-8201再次公布DB03研究的安全结果。在这更新的安全分析中,DS-8201显示一致,8201显示了耐受安全性。
除了乳腺癌,DS-8201仍在不断扩大适应症,并努力推进到更前沿的治疗方案。
今年ASCO,第一三公开DS-8201在HER2阳性不能切除或复发性胆管癌(BTC)二期临床疗效数据。DS-8201在HER2阳性的BTC患者表现出良好的活动。此外,第一共和第三共还公开了DS-8201胃癌新辅助治疗临床方案,主要目的是MPR 率。
科伦药业A166初步数据优秀
科伦药业A166是一款HER2 ADC,新的毒素分子通过蛋白酶裂解连接子(Duo-5、微管蛋白抑制剂)HER抗体(曲妥珠单抗)。
今年在2022ASCO科伦将在年会上公布A166用于多线治疗HER2.乳腺癌患者Ⅰ更新期剂量扩展研究数据。结果显示,4.8mg/kg客观缓解率(ORR)为73.9%,中位PFS为12.3个月,不良反应可控。
所有58名患者进行疗效评估,ORR和PFS数据如下:
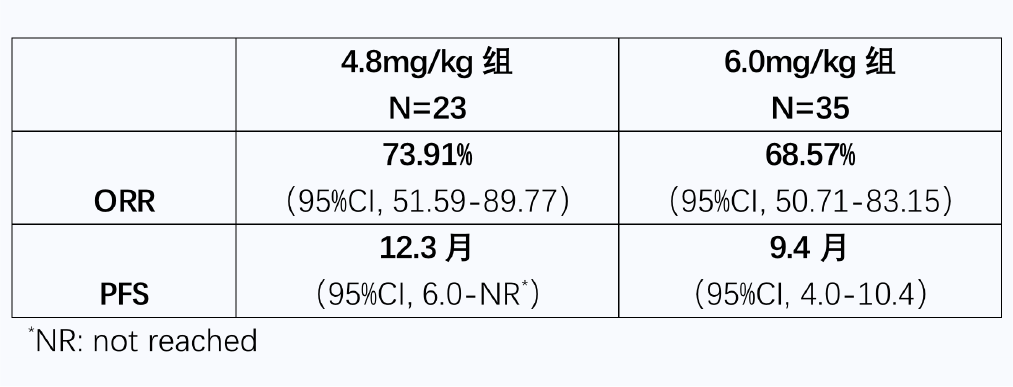
资料来源:科伦药业官网
4.8mg/kg组中,ORR为73.91%/17/22.CI,51.59 to 89.77) ,mPFS 为12.30月 (95% CI,6.00 to NR)。6.0mg/kg组中,ORR为68.57%(24/35)CI,50.71 to 83.15);mPFS 为 9.40月 (95% CI,4.00 to 10.40)。综合上述数据,A166在II临床研究推荐剂量为4.8 mg/kg。
比较第一三共DS-8201,乳腺癌适应症ORR为60.3%,mPFS为19.四月,目前,科伦在ORR但是数据比较好mPFS数据不及DS-8201。综合看,A166初步数据表现良好,但未来需要更大规模的临床验证。
乐普生物公布MRG2期研究数据002
MRG002是乐普生物开发的创新ADC该产品可与肿瘤细胞表面的特异性结合HER2.靶点通过表面受体介导细胞内吞入细胞并释放甲基澳瑞他汀E(MMAE),达到抗肿瘤效果。
今年ASCO会上,乐普生物将公布,乐普生物将公布MRG002治疗HER二期临床数据表达乳腺癌。
截至2021年12月31日,共有49例试验HER2-low可以评估女性晚期或转移性乳腺癌患者的数据。试验结果表明,患者的整体客观缓解率(ORR)34.疾病控制率为7%(DCR)为75.5%。
治疗相关不良事件最常见的是一级或二级,药物整体安全性良好。
从整体数据来看,经过多线治疗后,再次接受MRG002治疗的HER2低表达乳腺癌患者,ORR仍然有34.7%,数据令人鼓舞。
乐普生物也公布了MRG-002尿路上皮癌适应症研究结果。在单臂、多中心II在研究中,MRG002 初步结果表明,在治疗过程中HER-2 局部晚期或转移性,不能切除阳性UC 患者中,MRG002具有一定的疗效,安全性可控,进一步的评仍在进行中。
荣昌生物探索RC48新治疗模式
维迪西妥单抗是第一款获得批准的国产单抗ADC去年,该产品在中国获得了胃癌和尿路上皮癌的批准。
今年的ASCO在年会上,维迪西妥单抗的三项临床研究被选入今年的壁报讨论,这将构成维迪西妥单抗治疗尿路上皮癌的专题讨论。
这三项临床研究分别是迪西妥单抗和特里普利单抗联合治疗局部晚期或转移性尿路上皮癌Ib/II联合研究的初步结果;维迪西妥单抗在HER2阴性(免疫组化检查结果为0或1 )局部晚期或转移性尿路上皮癌Ⅱ临床研究;维迪西妥单抗治疗HER2表达(2 或3)转移性尿路上皮癌C005、C综合分析009临床试验。
此外,新的维迪西妥单抗肿瘤治疗模式也将出现在这次会议上,即联合放疗和免疫治疗HER2研究表达晚期难治性实体瘤(布拉格3).0研究)初步研究结果将首次公布。维迪西妥单抗和布拉格联合治疗有望进一步改善HER表达晚期难治性实体瘤的疗效,从而给患者带来新的好处。
结 语
目前ADC研发赛道竞争日益激烈。DS-8201珠玉在前,国产珠玉ADC赶上。去年6月和12月,荣昌生物的纬地西妥单抗在中国被批准用于胃癌和尿路上皮癌。还有很多国产的ADC初步的临床数据令人鼓舞,但最终,这些国内数据令人鼓舞ADC们能否超越DS-8201,还需要更多的临床数据支持。
如今DS-已获得上市申请CDE接受并获得优先评审资格,国产产品ADC研发需要加油。
