FDA召开关于PI3K抑制剂的ODAC会后 国内君实润佳PI3Kα临床批准的抑制剂
5月26日,上海君实生物医药科技有限公司PI3K-α抑制剂RP国家药品监督管理局批准颁发的《药品临床试验批准通知书》903件。PI3K-α抑制剂RP903片由君实润佳(上海)医药科技有限公司开发。
2019年2月,君实生物与润佳医药签订了《技术转让与合作协议》JS全球50%的权益,包括105在内的两个抑制剂项目。2021年4月,公司与润佳医药签订合资合同,共同投资设立君实润佳。君实润佳生物和润佳医药分别拥有君实润佳50%的权益,由君实润佳在合资区负责JS研发、临床应用、生产和商业化105个项目。
一、PI3K它是细胞内重要信号传导的重要分子。过度表达会导致肿瘤细胞的发生和持续发展
磷脂酰肌醇-3-激酶(PI3K)是细胞内磷脂酰肌激酶,是细胞内重要的信号转导分子,参与细胞增殖、凋亡、分化等生理过程的调节。自1988年以来PI3K第一次被发现一直是药物开发的重点。
在肿瘤细胞中,PI3K遗传学和表现遗传学突变依赖于性信号通路中的主要部件或上游调节因子,导致遗传学突变PI3K过度表达会导致肿瘤细胞的发生和持续发展。
针对PI3K突变的PI3K抑制剂在癌细胞中具有细胞自主作用。包括内部细胞凋亡的激活、糖代谢的减少、翻译抑制和通过FOXO转录因子的活性调控等。除了这些功能之外,PI3K抑制剂还能在体内和肿瘤微环境中发挥非细胞自主作用,能显著促进抗肿瘤作用。
PI3K根据其编码基因,可分为结构特征和底物特异性Ⅰ、Ⅱ、Ⅲ三种类型,共8个亚型。其中,与肿瘤关系最密切的是Ι四种亚型,即PI3Kα、PI3Kβ、PI3Kγ、PI3Kδ。
不同亚基的PI3K除了能在肿瘤增殖中发挥不同的作用外,还常与葡萄糖代谢、炎症发生、免疫等疾病领域有关。PI3Kα、PI3Kβ 在多个细胞中表达,PI3Kα 抑制剂的研究方向主要是乳腺癌等实体瘤。PI3Kδ、PI3Kγ 只在免疫系统中表达PI3Kδ、γ以血液瘤为主要抑制剂。
二、PI3K抑制剂不可避免的安全性
PI3K下游信号通路复杂,如果只是单纯抑制某种信号通路,PI3K亚型,肿瘤细胞仍然可以通过补偿机制逃脱。研究表明,为了达到抑制肿瘤的效果,必须能够抑制肿瘤PI3K催化活性至少为90%,但由于严重的不良反应,大剂量的抑制剂可能会导致一些患者不得不停药。
目前只有6款上市PI3K抑制剂药物或多或少存在安全问题。
1)Idelalisib(Zydelig):这是吉利德公司开发的一种高度选择性PI3Kδ2014年7月获得口服抑制剂,FDA批准上市。批准2年后,Idelalisib在临床试验中,发生了严重的不良事件,包括肝毒性、严重腹泻或肠炎、肺炎和肠穿孔等副作用。在临床使用中,中止率高达50%FDA和EMA给予警告和调查,然后吉利德宣布终止后续开发计划,基本等于撤市。
2)Copanlisib(Aliqopa):是拜耳研发的一款PI3Kα/δ2017年9月获得抑制剂,FDA加快批准上市。拜耳于2022年1月撤回Copanlisib上市申请欧盟用于治疗边缘区淋巴瘤。
3)Duvelisib(Copiktra):由Infinity先研发,后来License-out给Verastem Oncology,是一款PI3Kδ/γ2018年9月批准的抑制剂,安全性,Duvelisib具有与Idelalisib类似的副作用和黑框警告。Verastem Oncology治疗复发性或难治性滤泡性淋巴瘤症于2021年12月3日自愿撤回。
4)Duvelisib(Copiktra):是一款PI3Kδ/γ2018年9月,抑制剂,FDA复发性或难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤经批准治疗(R/R CLL/SLL)成人患者。Duvelisib在2016年被授权多次易主Verastem。2018年9月,石药集团获得中国独家药物权益,目前临床复发/难治性滤泡性淋巴瘤II期。但Copiktra标签上还有一个黑框警告,表明它具有致命和严重的毒性,包括感染、腹泻或结肠炎、皮肤反应和肺炎
5)Alpelisib(Piqray):这是诺华研发的一款PI3Kα2019年5月24日获得抑制剂FDA绝经后妇女与氟维司群联合治疗,激素受体呈阳性,HER-2阴性(HR / HER2-),基于内分泌治疗的经基因检测确实存在PIK3CA男性和女性突变,晚期或转移性乳腺癌。alpelisib与高血糖和皮疹有关的不良反应,患者停药率为25%。
6)Umbralisib(UKONIQ):是TG Therapeutics研发的一款PI3Kδ和CK1ε2021年2月获得抑制剂FDA批准上市。Umbralisib曾被美国FDA2022年1月暂停调查是否会增加患者死亡风险CLL 和 SLL 新适应症的两项临床试验,并自愿停止销售该药物。
根据科瑞伟安数据库,目前已进入临床阶段PI3K有65种抑制剂。
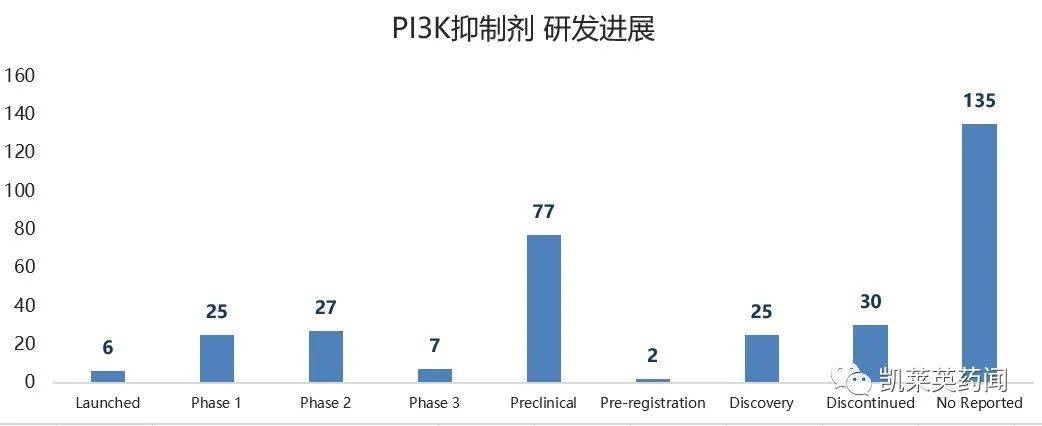
上个月美国FDA召开针对PI3K肿瘤咨询委员会召开的抑制剂(ODAC)会议受到广泛关注,会议也进行了讨论PI3K在血液恶性肿瘤领域,需要随机对照试验来支持这类药物的批准。

现阶段血液学恶性肿瘤PI3K抑制剂大多依赖于单臂试验中的总反应率(ORR)为了获得批准和加速批准资格,但单臂测试设计没有提供对照组,因此无法判断患者的各种副作用症状是否来自药物或疾病本身,对照组可能反映潜在的安全问题。除了单臂测试,FDA也指出有关批准PI3K抑制剂的总生存期(OS)剂量问题。他们认为,在药物开发过程中,研究人员没有有效地探索低剂量水平的疗效和安全性,以确定他们是否能在降低毒性的同时保持疗效。基于上述原因,最终ODAC16票同意,0票反对,1票弃权,同意PI3K重新规划药品开发审批框架。ODAC提出的三项建议包括:
? 通过早期随机试验(包括批准的药物)稳定的剂量探索,提倡仔细选择剂量;
?企业应采取随机试验,避免将单臂试验作为监管策略;
?充分收集和分析OS数据用于评估药物对这一最终安全终点的影响。
目前国内还没有监测到目标PI3K审批调整抑制剂。
三、PI3Kα 抑制剂
编码PI3Kα的基因PIK3CA作为癌症中高频突变的原癌基因,研究表明,平均15%的癌症会发生PIK3CA突变。PIK3CA突变导致PI3K过度活化,促进肿瘤增殖、转移和入侵,导致不良预后。这些突变被认为是多种癌症组织中的致癌物,最常见的是妇科恶性肿瘤、乳腺癌和头颈癌。例如,40%的人患有乳腺癌ER / HER2 -存在原发性和继发性肿瘤PIK3CA突变。
PI3Kα每年都有50多万人在美国突变,PI3Kα过度活化也与大多数人类癌症的耐药性和预后不良有关。目前的抑制剂只在
