合成多肽VS小分子化学药物:药学研究有什么区别?
文 | 药疯
简介:药物研发,特别是新药研发,在项目研究开始时,即将研究对象锁定为小分子药物或大分子生物药物,以配备一个具有巨大差异的研发团队。事实上,两者之间有一个大的方向,即多肽药物,近年来发展非常迅速,是新药研发企业不能轻易放弃的领域。现在,从技术的角度来看,介绍多肽药物,特别是近年来合成多肽药物的快速发展,其药学研究VS小分子药物有什么区别?如何解决这些问题?笔者将根据自己的项目研发经验和指导原则进行描述、分析和总结。
01
合成多肽-药物特征
多肽化合物是一种重要的生物活性分子。20世纪70年代生物技术在生命科学领域的应用,使得多肽等生物技术药物的研究进展迅速;随着多肽技术的不断进步,虽然大量药物被批准上市,占据了大量的市场份额,但一些品种已经完成了从常规注射到口服药物的转换,大大提高了患者的依从性,扩大了应用范围。
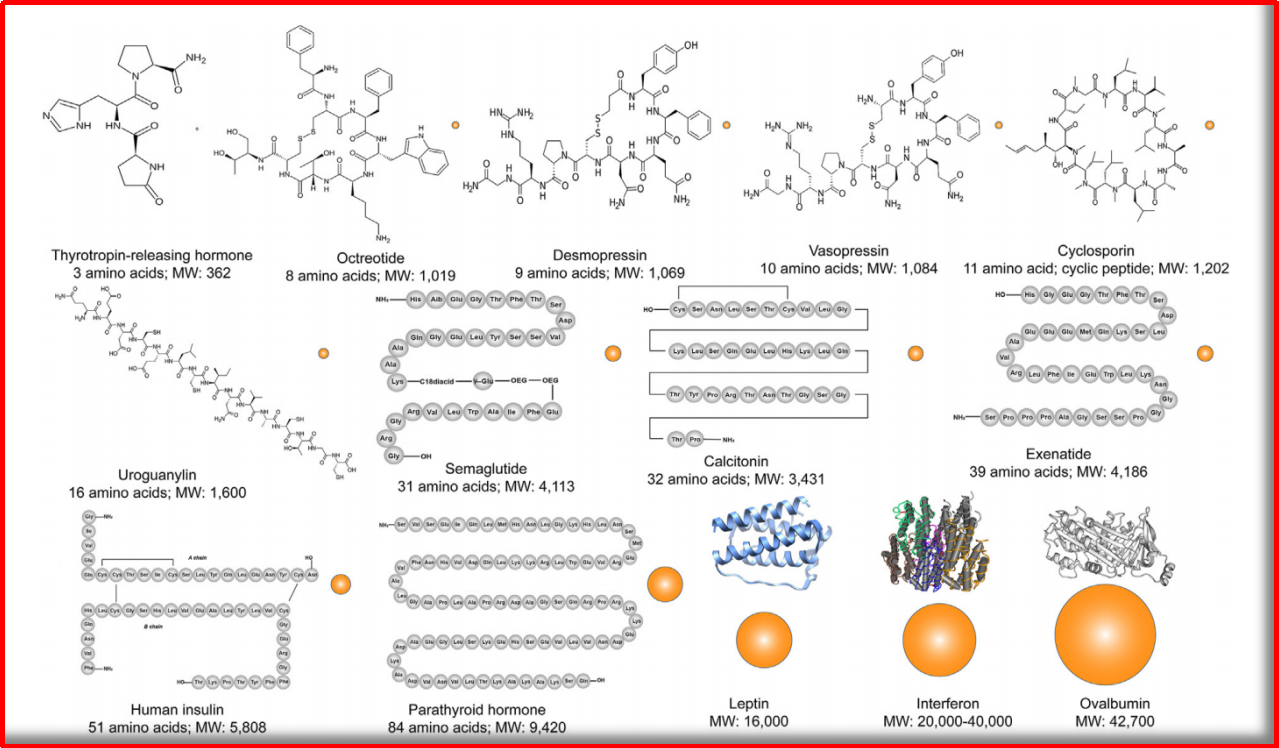
图1.1 蛋白质VS多肽~分子大小和化学结构示意图
(图片源:doi.org/10.1016/j.apsb.2021.04.001)
随着多肽固相合成技术和高效液相色谱纯化和分析技术的发展,合成多肽药物的发展也成为药物研究的一个活跃领域。化学合成方法可以改变天然多肽的结构,增加多肽和受体的亲和力和选择性,增强对酶降解的抵抗力或改善药物代动力学特性,甚至从受体的激动剂转变为拮抗剂;此外,新技术的发展,如基于多肽固相合成和组合化学的组合多肽库合成技术,使在短时间内获得大量多肽化合物成为可能,药物筛选效率不断提高。然而,由于多肽主要由氨基酸组成,多肽药物在制备方法、结构确认、质量研究等方面与普通药物不同。因此,本文将主要从技术角度介绍多肽药物与小分子化学药物的区别。
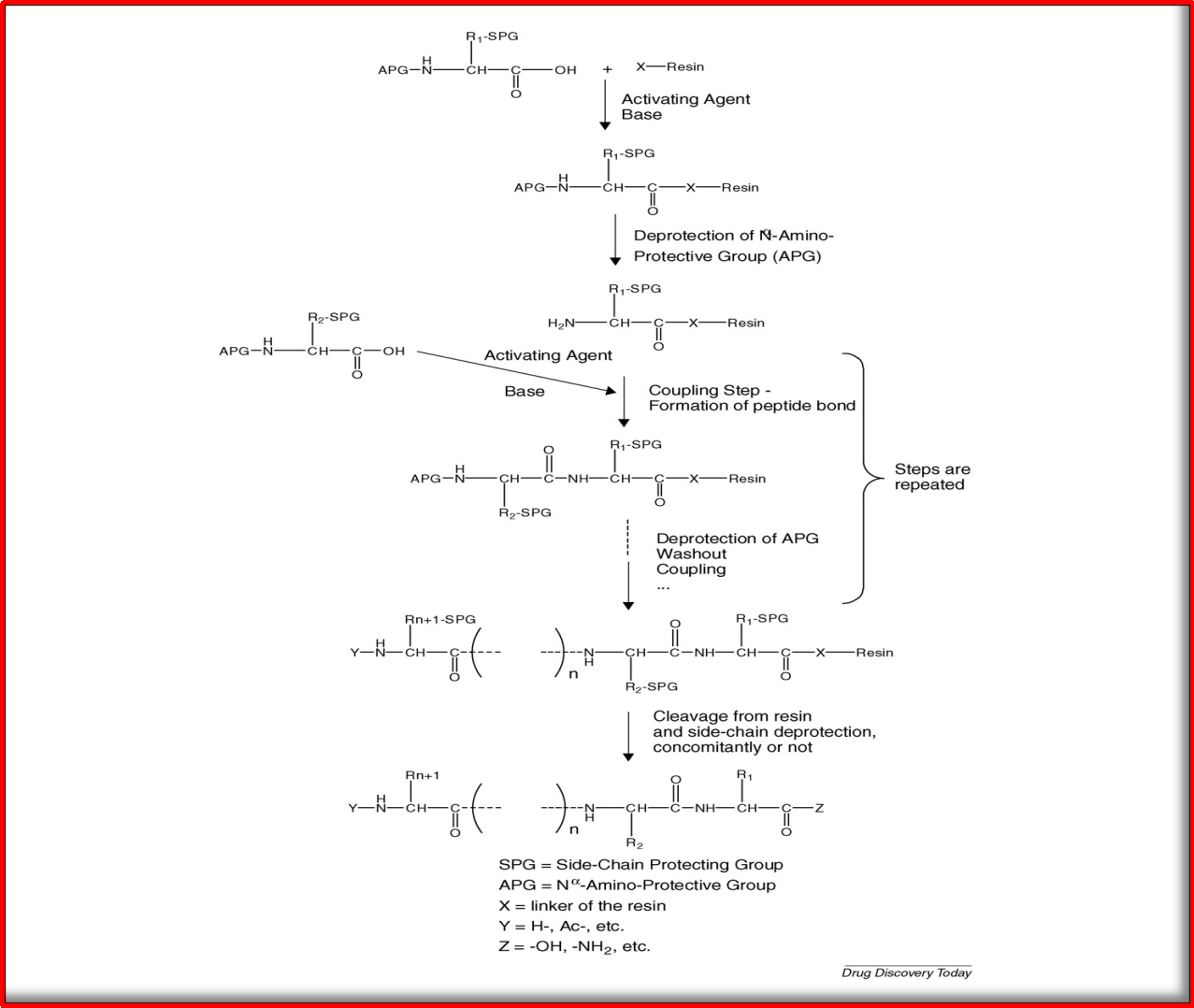
图1.2.固相肽的合成顺序和逻辑
(活化、偶联、保护、洗脱和切割)
(图片源:doi:10.1016/j.drudis.2009.10.009)
02
小分子化学药物的早期药学研究
为了更好的比较分析,首先重点介绍小分子化学药物的新药开发过程。
对于小分子化学药物,生命周期中的几个重要时间点可以归结为Hit、Lead、PCC、IND、I~III期临床、NDA、Launch,其中,IND申请可以说是前半生的一个重要里程碑。因此,相关技术指南是重要的研究基础指南。详情请参考国内CDE新药于2018年发布I申请临床试验的技术指南。关键内容如下:
?信息的格式和内容
I临床试验申请的申请材料应以纸质材料和电子材料的形式提交,电子材料可以提交CD以表格形式发送。格式和内容可参考研究人员药品注册技术要求的国际协调会议(ICH)通用技术文件(CTD)要求整理提交。
?药学研究信息
随着药物研究的深入,不同的研究阶段有不同的研究目的。新药申请Ⅰ临床研究的药学研究数据应遵循药物研发规律,重点关注与计划研究受试者安全相关的药学研究信息(如杂质谱基于现有知识的分析、物质检测的独家性和灵敏度的方法学验证、潜在遗传毒性杂质的分析和控制、,生物新药的免疫原性和免疫毒性等)。根据药学部分提供的信息,当担心安全问题或数据不足以进行安全评估时,临床试验应暂停。此外,对于具有生物毒性、放射性核素等的新药,或涉及生物安全风险的新药,应提供相关研究材料、研究计划和风险控制措施,按照国际通用技术指导原则。PS:具体小分子化学药物IND阶段性药学研究见下表。
表2.1IND阶段性药学研究内容

03
小分子化药NDA注重药学阶段
创新药物的研究具有阶段性特征。不同阶段的研究深度是满足不同阶段非临床/临床研究的要求,以满足安全性、有效性和质量可控性。
上面,我经历过小分子化学药物IND阶段结束后,药学研究也需要不断完善,以完成药学研究的最终全套数据,最终冲向NDA。在这个过程中,通常会有很多变化。详见《创新药物(化学药物)临床试验药物变更技术指南》;在研发过程中,每年都会有许多额外的研究内容DSUR中体现;而且在临床后期,也可以参考创新药(化学药)III《临床试验药学研究信息指南》;NDA,可参考《化学药品创新药品上市前会议药学常见问题及相关技术要求》。PS:下表对NDA总结了一些常见的药学问题和解决方案
