联合生物:UB-221治疗慢性自发性荨麻疹2期IND获TFDA批准
发布时间: 2022-05-31 10:48:45
台湾联合生物宣布,2022年5月29日,台湾省食品药品监督管理局(TFDA)已批准新型抗抗抗IgE单克隆抗体UB-221 临床试验2200000000000000000000000000000000000000000000000000000UB-221 作为治疗慢性自发性荨麻疹的长期附加疗法(CSU治疗效果,并证明UB-221 6个月期间两个高剂量组的潜力。

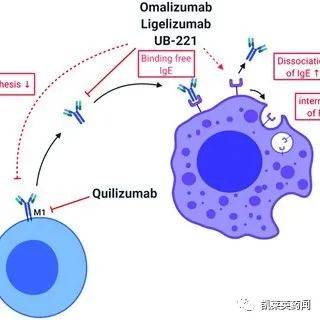
UB-221 是一种 IgG1,靶向 IgE 抗体的 Cε3.结构域,通过和B 细胞表面FcεRII (CD23)IgE 并抑制 IgE合成。临床前研究表明,UB-221IgE治疗性抗体(Xolair8倍)IgE合成抑制作用需要1/10剂量huIGHE在小鼠模型中敲击效果是一样的。1 期临床试验表明,CSU 患者对 UB-221 单次给药后反应迅速,血清游离IgE几个星期到几个月的抑制,表明UB-221 可以比 Xolair更有效地缓解 CSU 症状。UB-221 也可以通过低亲和力受体CD23IgE压制新 结合IgE因此,停药后产生,IgE反弹速度会变慢。
急性荨麻疹分为急性荨麻疹(
