创新ADC获FDA优先审查资格 华东医药在大中华区拥有权益
ImmunoGen公司今天宣布,美国FDA该公司已被接受为靶向叶酸受体α(FRα)抗体偶联药物(ADC)mirvetuximab soravtansine提交生物制品许可申请(BLA),作为单药疗法,治疗FRα治疗晚期卵巢癌的高表现,对含铂疗法耐药。FDA同时授予这一BLA预计在今年11月28日之前,月28日前作出答复。
成功控制疾病的一大挑战是卵巢癌患者对含铂疗法产生耐药性。FRα作为叶酸受体家族的一员,它以高亲和力与叶酸结合,导致它们被吞入细胞中。此前的研究表明,FRα高度表现为上皮卵巢癌76-89%和三阴性乳腺癌35-68%。FRα成为引人注目的药物靶点。FRα介导信号通路可以影响肿瘤细胞的分裂和迁移,从而抑制肿瘤细胞的分裂和迁移FRα也会产生一定程度的直接抗癌活性。
Mirvetuximab将与FRα结合了能产生细胞毒性的人源性单克隆抗体DM四分子通过二硫键连接。ADC与FRα结合之后,FRα能够将ADC向细胞内部转移,ADC携带的细胞毒性分子可以抑制肿瘤细胞的有丝分裂。值得一提的是,2020年10月,华东医药在大中华区获得了独家开发和商业权益,价值超过3亿美元。
这个申请是基于关键的三期临床试验SORAYA结果。106例肿瘤表达高水平的肿瘤表达已纳入3期临床试验FRα对于含铂耐药卵巢癌患者,患者中位数为3线,均接受贝伐珠单抗治疗。研究人员评估的客观缓解率达到了主要目的,并确定了实验结果(ORR)为32.4%(95% CI:23.6%,42.2%),包括5例完全缓解(CR),以前的治疗线数或以前的治疗线数PARP抑制剂(PARPi)治疗无关紧要。中位缓解持续时间(DOR)截至2022年3月3日,在关键次要终点,研究者评估的中位数DOR为6.9个月(95% CI:5.6,8.1)。此外,研究人员评估的中位无进展生存期(PFS)为4.3个月(95% CI:3.7,5.1)。
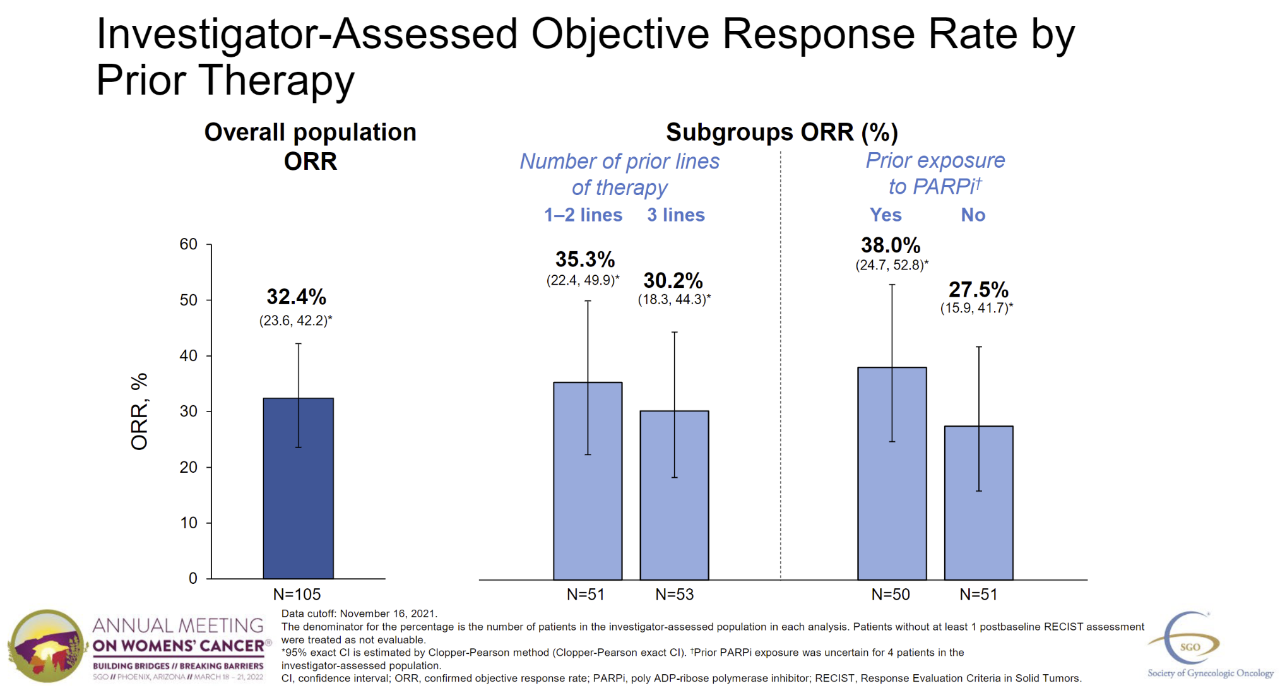
图片来源:参考资料[2]
ImmunoGen公司总裁兼首席执行官Mark Enyedy先生表示,FDA授予这一BLA优先审查资格证明公司mirvetuximab soravtansine潜在的信心,它有成功的信心FRα高表达,新标准治疗卵巢癌含铂疗法耐药的潜力。
参考资料:
[1] ImmunoGen Announces Acceptance of Biologics License Application for Mirvetuximab Soravtansine in Ovarian Cancer by US Food and Drug Administration with Priority Review. Retrieved May 23,2022,from https://www.businesswire.com/news/home/20220523005222/en/
[2] Efficacy and Safety of Mirvetuximab Soravtansine in Patients With Platinum-Resistant Ovarian Cancer With High Folate Receptor Alpha Expression: Results From the SORAYA Study. Retrieved March 21,2022,from https://www.immunogen.com/wp-content/uploads/2022/03/SGO-2022_SORAYA_Oral-Presentation_Matulonis_vF-1.pdf
