CAR-T药品还是医疗技术?监管挑战与对策,细胞治疗商业化
编辑:安非他命:

20222000年5月11日,上海市药品监督管理局官网发布《上海市自体公开征集》CAR-T《细胞治疗药疗药品监督管理暂行规定》的意见通知,公开征集意见的时间为:2022年5月11日至6月10日CAR-T《细胞治疗药品监督管理暂行规定》规定了自我治疗CAR-T细胞治疗药物的监督管理要求弥补了国内自身的不足CAR-T细胞药品监督管理要求领域的空白,本文是关于上海的CAR-T分析了《细胞治疗药品监督管理暂行规定》中的重点。
1、CAR-T细胞治疗产品
属于药还是医疗技术?
CAR-T细胞,即嵌合抗原受体,T通过基因修饰技术,细胞将具有特异性抗原识别结构域和结构域T遗传物质转移到细胞激活信号T细胞,使T通过释放穿孔素和颗粒酶素,通过与肿瘤细胞表面的特异性抗原直接结合而激活细胞B同时,通过释放细胞因子来收集人体内源性免疫细胞来杀死肿瘤细胞,从而达到治疗肿瘤的目的T细胞。
此前,根据卫生部《医疗技术临床应用管理办法》等相关规定和要求,自体干细胞和免疫细胞疗法被列为第三类医疗技术进行管理。鉴于细胞治疗技术的逐步改进,2017年12月,国家食品药品监督管理局药品评价中心发布了《细胞治疗产品研究与评价技术指南》(试行),代表细胞治疗产品从第三医疗技术向药物监管的过渡,指南明确指出,细胞治疗产品是指人类疾病的治疗、来源、操作和临床试验过程符合伦理要求,人类来源的活细胞产品按照药物管理的有关法律、法规进行开发和注册。
2、自体CAR-T细胞药品商业化
挑战与对策
1、细胞治疗产品人员有哪些特殊考虑?
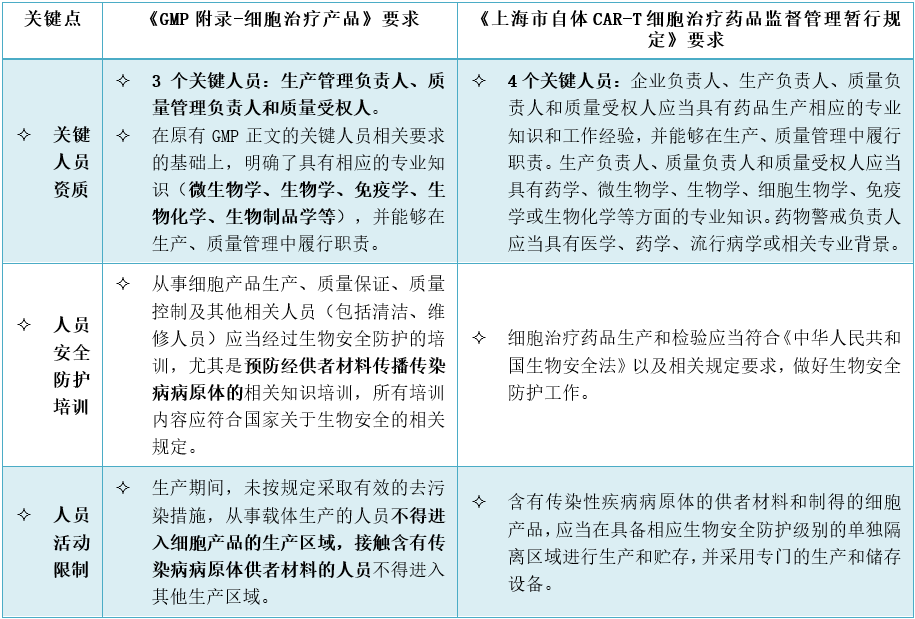
2、细胞治疗产品的生产设施和设备有哪些特殊考虑?
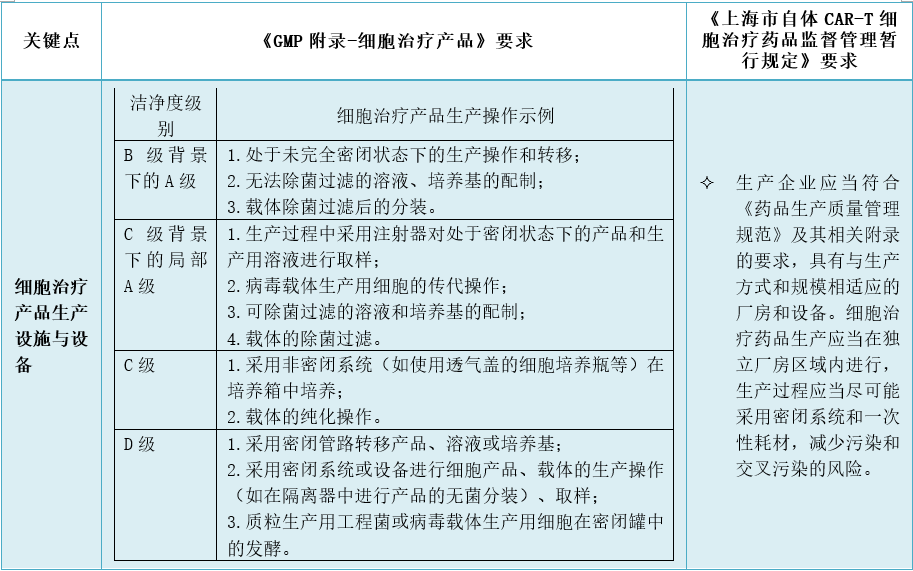
3、细胞治疗产品材料有哪些特别考虑?

4、细胞治疗产品生产管理有哪些特别考虑?
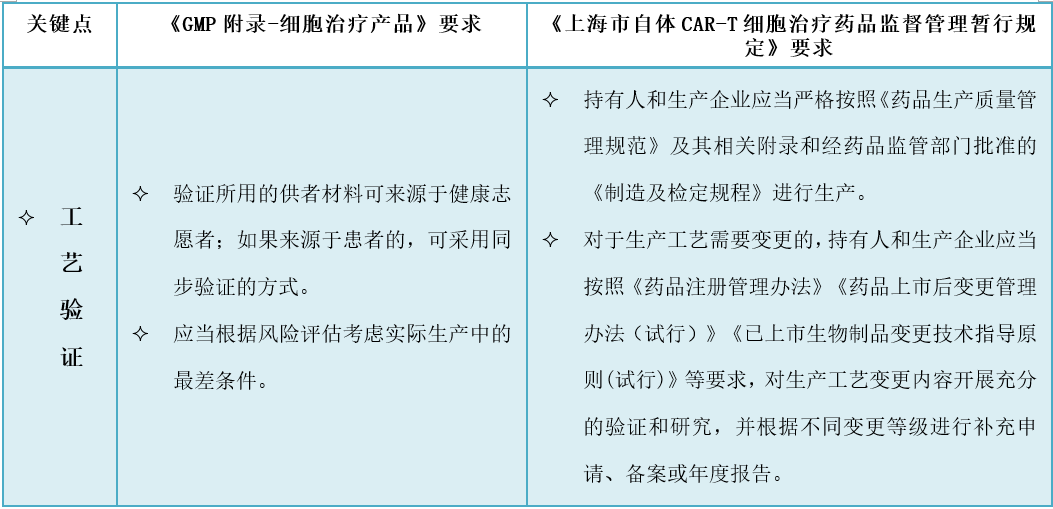
5、细胞治疗产品质量管理有哪些特别考虑?

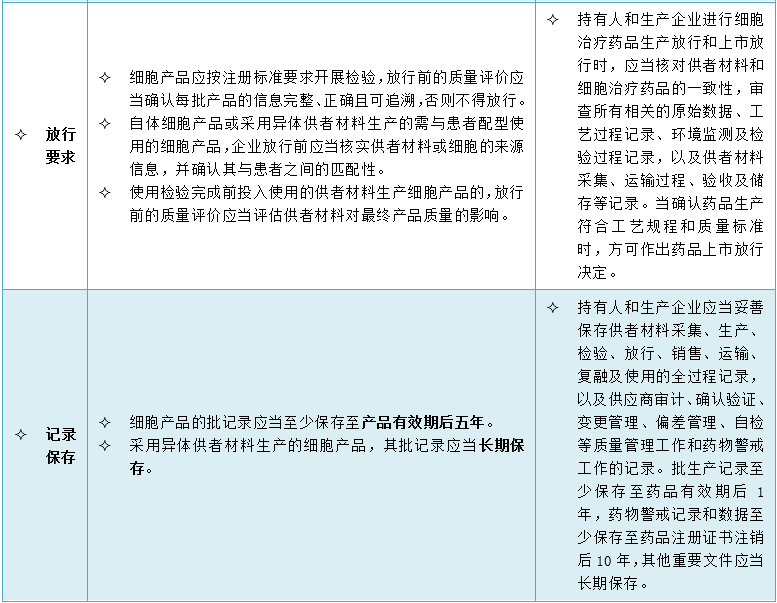
6、产品追溯系统有哪些特别考虑?
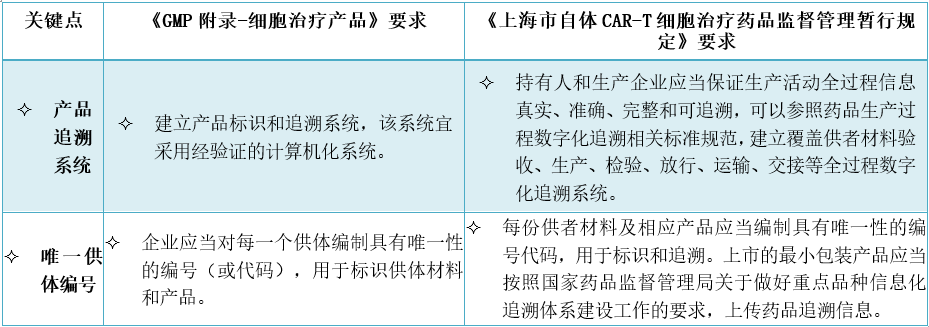
3、小结
细胞治疗产品是当今新药研发的热点,其商业生产由于没有针对性的监管规则,风险控制意识薄弱,使医疗机构和患者面临诸多风险,甚至影响细胞治疗行业的健康发展,上海作为国家科学创新中心和生物医学研发产业,在细胞治疗产品研发中相当活跃,已开始成为产业化的基础。
为了解决细胞治疗商业化发展的瓶颈,上海食品药品监督管理局组织起草了《上海自体》CAR-T《细胞治疗药品监督管理暂行规定》将加快细胞治疗的商业化和标准化,为制定我国细胞治疗行业的监管标准提供有益的参考。
参考资料来源:上海市药品监督管理局
