传奇生物cilta-cel获FDA批准上市 国产CAR-T目标竞争蓄势待发
文丨rainbow
2月28日,美国东部时间FDA传奇生物的靶向生物的靶向BCMA嵌合抗原受体T细胞(CAR-T)产品Ciltacabtagene autoleucel(cilta-cel,西达基奥仑赛,商品名称为Carvykti)。作为第2款BCMA CAR-T,Carvykti的定价为46.5万美元。
cilta-cel传奇生物自主研发的一种用于治疗成人复发和/或难治性多发性骨髓瘤(R/RMM)的靶向的BCMA的CAR-T疗法,包括一个4-1BB共刺激结构域和两个BCMA靶向单域抗体。
这一次,传奇生物cilta-cel在美国正式获批上市,成为中国第一家自主研发公司CAR-T产品出海成功典范。
cilta-cel:传奇生物CAR-T治疗领导者
cilta-cel它是传奇生物一举成名的产品,在监管动态方面也不乏魅力:
- 2018年,该疗法获得中国国家药品监督管理局首个CAR-T临床试验申请(IND)批件和美国FDA的IND批准;
- 2019年,cilta-cel欧洲药品管理局优先药品认定(PRIME)资格及美国FDA被授予的突破性疗法。
- 2020年12月,FDA提交cilta-cel申请生物制剂许可证(BLA);
- 2021年5月,cilta-cel上市申请以优先审查受理,处方药用户费用法案(PDUFA)时间为2021年11月29日,
- 2021年11月,传奇生物宣布FDA已将cilta-cel的PDUFA 目标行动日期延迟3个月至2022年2月28日。(这次。FDA延长评审时间,但不要求公司提交新的临床数据,这意味着审批延期和审批延期cilta-cel试验数据无关)
据悉,cilta-cel提交上市申请(BLA)主要是基于关键Ib/II期CARTITUDE-1.对研究结果进行评估ciltacel复发性和/或难治性多发性骨髓瘤患者的有效性和安全性。97名受试者中,99%接受过最终治疗,其中88%至少接受过三线治疗。
研究结果显示,中位随访12.4个月时间,独立委员审查ORR97%,包括67%sCR(严格完全缓解),26% VGPR(非常好的部分缓解)和4%PR。≥三级细胞因子综合征(CRS)发病率为5%,≥三级神经毒性发生率为10%。
除了之前突出的临床数据外,在不久前的第40届摩根大通医疗健康年会上,传奇生物首席执行官兼首席财务官黄英博士还宣布cilta-cel临床试验最新数据:中位24个月长期随访后,主要终点指标总缓解率(ORR)达到97.9%,VGPR为94.9%,其中82.患者达到5%sCR。有60.2年后,5%的患者存活,无疾病进展。MRD61例可评估患者,92%的患者达到10%-5MRD阴性。
除了这个跑在监管胜利终点的人cilta-cel,在血液瘤领域,传奇生物为多个潜在靶点开发了单靶点/双靶点/三靶点 CAR-T 产品,包括 BCMA、CD4、CD20、CD33/CLL-1、CD19/CD20/CD22 等。其中,自体,自体。CD4靶向CAR-T疗法LB1901已经通过了FDA的IND申请并在美国启动Ⅰ期临床试验用于治疗成人复发性或难治性外周性T细胞淋巴瘤(PTCL)或皮肤T细胞淋巴瘤(PTCL),为传奇生物管道研发进展迅速的产品。
值得注意的是,本月早些时候,传奇生物收到FDA电子邮件说:这个LB1901的I临床试验被暂停。至于暂停的原因,FDA没有提及传奇生物。然而,据了解,临床试验并非被提及。FDA停止,但受试者出现了情况。
在实体瘤领域,传奇生物开发了多种应对胃癌、肝癌、小细胞肺癌、非小细胞肺癌和卵巢癌的产品,包括靶向Claudin18.2的LB1908和靶向MSLN的LB1902年已经进入了I期临床。
此外,传奇生物还拥有嵌合抗原受体自然杀伤细胞(CAR-NK)平台。
CAR-T市场前景广阔,第一个靶向BCMA产品迎对手
CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy)细胞疗法已被证明是对抗血液癌症的强大武器。该疗法是治疗肿瘤的一种新的精确靶向疗法,其原理是对患者血液的天然抗感染和抗癌免疫细胞T细胞在体外进行基因重编程,重编患者T细胞,经过体外培养和改造,重新输入患者体内,可以识别患者体内癌细胞上的抗原标记物。然后,利用细胞培养技术扩展这些CAR-T细胞,并将其重新注入患者体内攻击癌症。
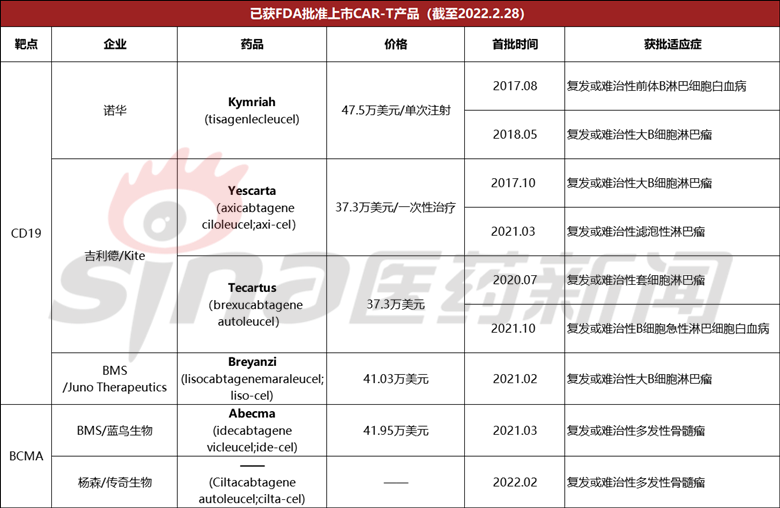
到目前为止,美国FDA已批准6款CAR-T细胞疗法上市,包括四种靶向治疗CD19,两款靶向BCMA。
市场方面,根据弗若斯特沙利文的数据,全球数据,CAR-T从2017年00年开始,细胞治疗市场.2019年1亿美元增长至7亿美元,2020年11亿美元,预计未来几年将加速增长,2024年将扩大至66亿美元,2030年市场将进一步增长至218亿美元。
根据近日各大药企发布的2021年业绩公告:
- 最早上市的诺华Kymriah2021年销售额达到55年.87亿美元,同比增长24%。
- 接着是吉利德的两款产品:Yescarta2021年销售额为6.与去年相比,9亿美元增3%;Tecartus第一个完整的财年也实现了1.7亿美元的销售收入。
- 百时美施贵宝去年上市Breyanzi第一年业绩不尽如人意,仅0.87亿美元,后一个月获批Abecma,作为当时世界上唯一的靶向目标BCMA的CAR-T疗法,其首年销售额为1.64亿美元,接近于Breyanzi年销售额的两倍。
而cilta-cel作为世界第二批获批上市的目标BCMA的CAR-T疗法,之后最直接的竞争对手——来自百时美施贵宝的同一赛道Abecma,该产品的销售额是正确的cilta-cel有一定的参考价值,虽然该产品的第一年销售额与前几款相比较CAR-T产品可能不尽如人意。
但是,根据之前的临床数据,Abecma之前接受过三种治疗的中位患者OS为24.8个月,ORR患者达到73%,33%CR。以上介绍,传奇生物cilta-cel临床数据显示:它ORR98%、80%的患者实现了sCR,同时,安全也有一定的差异化优势。
由此可见,cilta-cel未来的销售可能会略胜一筹。
据了解,早在cilta-cel在形成之前,传奇生物已经被巨人收录了MNC青睐。2017年12月,传奇生物与强生旗下的杨森达成全球合作和许可协议。根据合作协议,在大中华区,传奇生物和杨森按7:3的比例共同承担成本和分享收入;在世界其他地区,两家公司分为五五份。
目前,传奇生物已获得3分.预付款25亿美元,预付款25亿美元.5亿美元的里程碑支付。
国内企业不愿落后,CAR-T目标竞争蓄势待发
国内方面,品药品监督管理局已批准上市两款CAR-T产品,都是靶向的CD19.这两种产品分别是复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥伦赛注射液。据悉,两款产品均为合作引进产品,阿基仑赛注射液由复星凯特向Kite公司奥仑赛注射液由药明巨诺引进Juno公司引进。
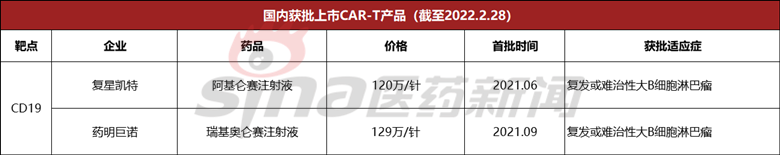
值得一提的是,2月27日,药明巨诺发布公告称,其子公司旗下的药明巨诺发布公告称,其子公司旗下的药明巨诺发布公告称,其子公告称,其子公司旗下的药明巨诺发布公告称,CAR-T瑞基奥伦赛注射液第二适应症已被国家食品药品监督管理局接受,用于治疗复发或难治性(r/r)滤泡淋巴瘤(FL)患者。
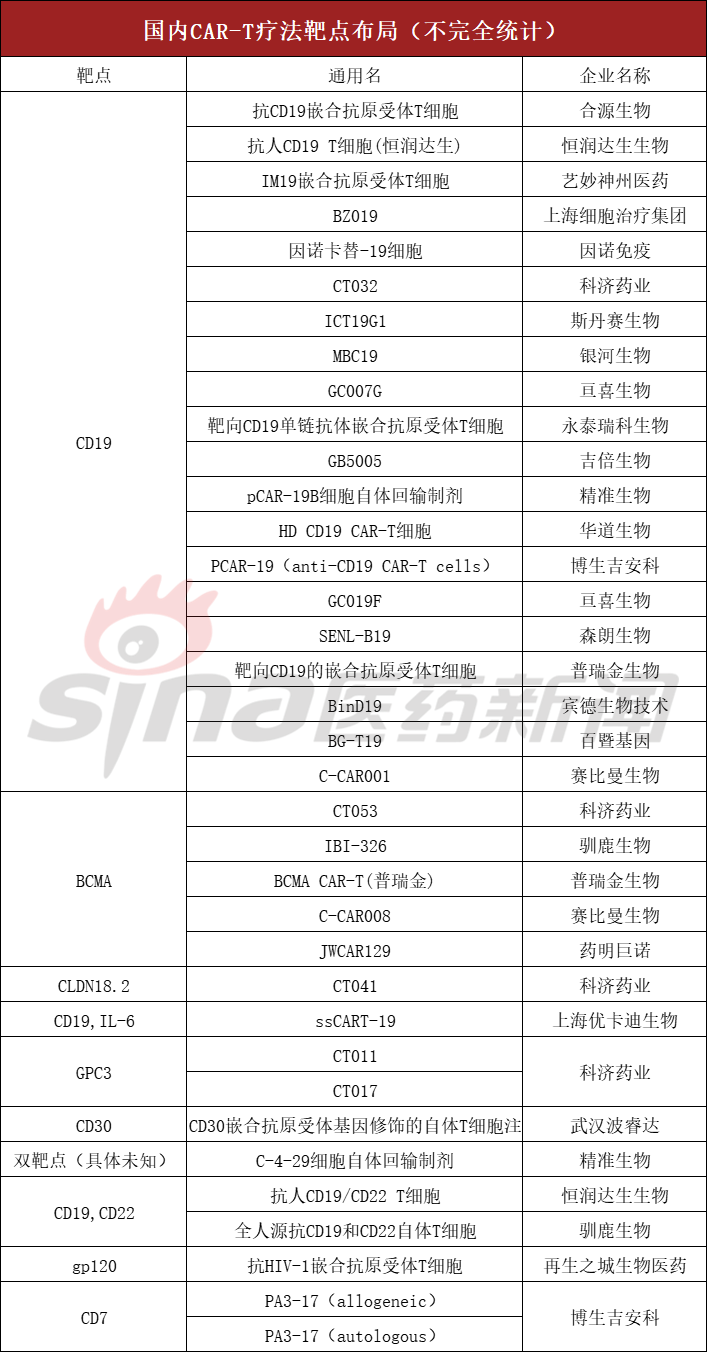
此外,中国还有合源生物、科济药业、艺术中国等企业积极加入,其产品已进入临床阶段。其研发目标主要集中在研发目标上CD19,其次为BCMA,也不乏双目标产品。
参考资料来源:药渡全球药渡《全球药渡》CAR-T疗法研发图
