如何克服非小细胞肺癌?EGFR和ALK抑制剂耐药性?
表皮生长因子受体(EGFR)间变性淋巴瘤激酶(ALK)重排是非小细胞肺癌(NSCLC)驱动因素,其发现和靶向治疗的发展,促进了晚期患者基于生物标志物精确治疗模式的发展。目前,已有多种类型EGFR和ALK酪氨酸激酶抑制剂(TKI)如果上市,如果第三代疗效显著,EGFR奥希替尼抑制剂(osimertinib)和ALK抑制剂洛拉替尼 (lorlatinib)。但尽管疗效显著,患者最终还是会出现获得性耐药性。
近日,《自然》子刊Nature Reviews Clinical Oncology发表一篇题为《第三代》的文章EGFR和ALK抑制剂:耐药机制与管理总结,详细介绍第三代EGFR和ALK抑制剂耐药性的产生机制,并描述了克服耐药性的各种策略。在今天的文章中,药明康德的内容团队将为读者带来精彩的内容。点击文章末尾阅读原文/Read more您可以访问原始论文页面。

奥希替尼和洛拉替尼简介
奥希替尼是第三代,不可逆EGFR TKI,对典型的EGFR激活突变和T790M耐药性突变具有强的效果和选择性。洛拉替尼是第三代、大环、高效和选择性。ALK/ROS1 TKI,用于解决早期问题ALK TKI获得性耐药,广谱ALK耐药突变在激酶结构领域的作用。
不过,尽管是第三代EGFR和ALK TKI疗效显著,但其获得性耐药性不可避免,仍是一个尚未解决的问题。因此,进一步研究阐明耐药性的潜在机制是非常重要的。
奥希替尼和洛拉替尼耐药性的机制
从广义上讲,获得性耐药可分为靶点依赖性(on-target)耐药性(涉及靶点激酶的变化,使即使存在TKI,持续激酶激活或信号传导仍会发生)或非靶点依赖性(off-target)耐药性(涉及靶点下游信号传导蛋白上升或细胞表型转化后一个或多个旁路信号通路的激活)。
靶点依赖性耐药机制
就奥希替尼的靶点依赖性耐药性而言,奥希替尼通过与位于奥希替尼的靶点依赖性耐药性和位置ATP半胱氨酸与位点结合797(C797)形成共价键EGFR结合起来。因此,,因此,,,,,,,,,,,,。C797残基是奥希替尼耐药性产生的易感位点,事实上,在10%~26在接受二线奥希替尼治疗后,发现了疾病的进展EGFR C797S突变。
洛拉替尼靶点依赖性耐药突变多为复合性耐药突变ALK基因突变,这些复合突变包括激酶蛋白领域的两个以上突变,叠加在一起,以降低洛拉替尼的活性,或阻碍药物的结合。对患者组织样本的一系列分析发现,患者的肿瘤随着接受程度的不同而不同ALK抑制剂的治疗可以一步积累ALK耐药性突变,最终携带高耐药性复合突变,使目前大部分复合突变,ALK抑制剂失效。
非靶点依赖性耐药机制
历史上,对非靶点依赖性耐药机制的研究更具挑战性,因为这些机制可能涉及非基因组或非细胞自主机制,而肿瘤测序可能无法识别这些机制。事实上,尽管你在理解EGFR/ALK抑制剂的非靶向依赖性耐药性取得了实质性进展,但相当大一部分患者(一线奥希替尼治疗后高达40%)~50%)其耐药机制尚不清楚,这强调了该领域需要进一步研究。
MET扩增是在EGFR突变型NSCLC第一个涉及旁路信号传导的耐药机制。重要的是,MET扩增可以靶向,EGFR抑制剂结合MET临床试验中的组合在临床试验中取得了可喜的效果。MET扩增也是NSCLC其他分子亚群(包括ALK重排NSCLC)耐药机制之一。
此外,EGFR和/或ALK下游信号通路可重新激活并引导耐药性。RAS-MAPK通路是EGFR和ALK关键的下游效应通道可以通过影响通道各节点的各种机制(如获得性)BRAF融合、KRAS突变、NRAS突变、MAP2K1突变、DUSP6缺失或野生NRAS或KRAS扩增)重新激活。临床前模型的数据显示,上调显示,上调显示ERK信号传递赋予第三代EGFR抑制剂的耐药性,结合MEK/ERK抑制可以恢复正确EGFR TKI的敏感性。
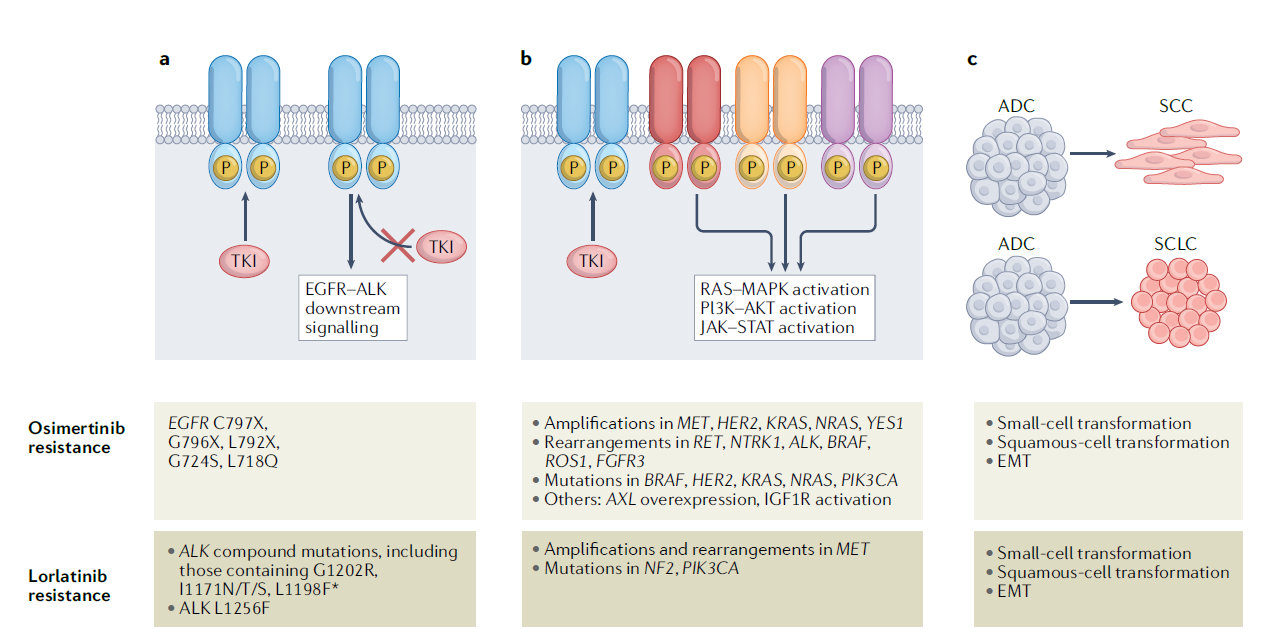
▲EGFR突变和ALK重排的NSCLC中奥希替尼和洛拉替尼的获得性耐药机制:包括防止TKI抑制靶受体酪氨酸激酶的变异(a)、激活旁路和/或下游信号通路(b)、肿瘤细胞谱系的变化,如腺癌(ADC)转化为鳞状细胞癌(SCC)或小细胞肺癌(SCLC)表型与上皮间质转化(EMT)(c)(图片来源:参考资料[1])
癌症组织学特征的转化也是耐药性的重要机制之一。EGFR抑制剂耐药性NSCLC患者中,3%~14%的患者转化为小细胞肺癌(SCLC),这种转变在一线奥希替尼治疗后可能更为常见。从腺癌到鳞状细胞癌的转化也可能发生,这也与转化后的短生存时间有关。ALK抑制剂治疗后,还发现了小细胞肺癌和鳞状细胞癌的转化。上皮细胞癌。-间质转化(EMT)也在EGFR突变和ALK癌症患者被发现并被认为是促进侵袭。EMT这是一个保守的发展过程,上皮细胞表现为迁移和侵袭性间充质表型、细胞-细胞连接和极性丧失。这一过程与抗肿瘤治疗的原发性和获得性耐药有关,EMT转录调节因子已被确定为肺腺癌患者可能的治疗目标。
克服耐药性的各种策略
在接受靶向治疗(包括奥希替尼和洛拉替尼)后,临床疾病的进展速度和模式非常不同。因此,需要根据疾病进展的特点和对上述耐药性机制的理解来确定最佳的管理策略。
例如,治疗后只有一个或少数小转移病变的患者可以使用局部切除或三维定向放射治疗。相比之下,多灶性中枢神经系统(CNS)疾病的进展通常需要一种替代治疗策略,比如使用培美曲塞(在转移性腺癌患者中有一定的可替代性)CNS疗效)、全脑放疗、转化为CNS试图增加渗透性较强的抑制剂或增加剂量CNS药物浓度。
新一代EGFR和ALK抑制剂
对于弥漫性和全身性疾病的患者,有必要改变系统治疗的方法。在这里,选择可以大致分为替代品TKI(克服靶点依赖性耐药)和TKI除单药治疗外的策略(旨在解决非靶点依赖性耐药性)。
许多第四代EGFR和ALK TKI在发展中,旨在解决第三代问题TKI靶点依赖性耐药性。Blueprint Medicines公司开发的BLU-945和BLU-701是两种口服可逆选择性TKI,在抑制EGFR激活性和耐药性突变不影响野生激酶的活性。它们可以作为单一药物或组合疗法的一员在各种临床环境中治疗NSCLC病人。中国再鼎医药拥有这两款第四代EGFR抑制剂在大中华区的发展权益。

▲BLU-945和BLU-701活性特征(图片来源:Blueprint Medicines公司官网)
最近结束的AACR大会上,Blueprint Medicines公布了BLU-945临床数据的初步概念验证。早期临床试验数据显示,BLU-945安全性好,剂量依赖性降低循环肿瘤DNA。此外,放射影像学数据显示,肿瘤的剂量依赖性降低,其中一个接受最高剂量BLU-945患者得到部分缓解。
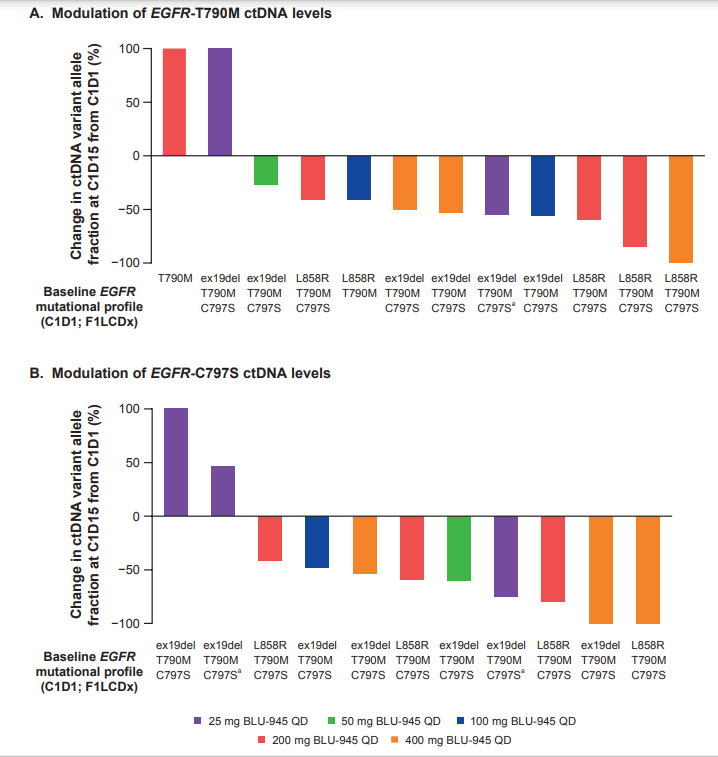
▲BLU-945剂量依赖性降低循环肿瘤DNA(图片来源:Blueprint Medicines官网)
其它第四代EGFR包括抑制剂EAI045和JBJ-04-125-02,它们都是别构EGFR抑制剂。
在新型ALK TKI开发方面,Turning Point Therapeutics开发的TPX-0131是第四代ALK TKI,紧凑的大环结构可以完全和紧凑ATP口袋中腺嘌呤位置的结合,即使有ALK耐药突变也可以抑制ALK。该化合物目前正在进行一期临床试验。Nuvalent新一代的发展CNS渗透性ALK抑制剂NVL-655预计将于2022年进入一期临床试验。值得一提的是,单一创新,单一创新。ALK TKI可能不足以克服所有导致洛拉替尼耐药性的复合突变。这也凸显了肿瘤一旦积累复合突变,就很难有效抑制靶点。
联合治疗
联合治疗通过第三代联合治疗EGFR或ALK抑制剂与其他药物的结合可以解决或延缓第三代抑制剂耐药性的发生。
首先,早期和第三代针对相同的靶点可以同时使用TKI,为了解决或延缓靶点依赖性耐药性的出现。例如,在EGFR突变NSCLC中、奥希替尼和第一代EGFR TKI在某些等位基因背景下,可以克服与C797S与突变相关的耐药性。
另一种组合疗法的策略是使用组合疗法EGFR或ALK TKI与另一种靶向疗法一起,针对非靶向依赖性耐药性。例如,在这里,ALK重排NSCLC在病人中,洛拉替尼和MET抑制剂(靶向MET驱动耐药性),MEK抑制剂(靶向RAS-MAPK重新激活信号通路),或SHP2临床试验中评估了抑制剂组合疗法。
研究人员现在也在探索EGFR或ALK TKI与抗血管药物或免疫疗法相结合。然而,目前的临床试验结果并不能确定组合疗法是否能带来显著的疗效改善。
创新疗法和未来发展方向
文章指出,抗体偶联药物(ADC)双特异性抗体是目前正在开发的一种新的治疗方法。它们可能对抗双特异性抗体。TKI耐药性癌症患者有效。这些药物有克服多种耐药机制的潜力,因此值得特别关注。
比如,amivantamab是一款靶向EGFR和MET它已经获得了双特异性抗体,它已经获得了双特异性抗体,FDA加快批准,携带治疗EGFR外显子20插入突变NSCLC病人。而且,它与第三代有关。EGFR抑制剂lazertinib联合使用,在携带特定突变的奥希替尼经治患者中,客观缓解率达到36%(ORR)和4.9一个月的中位没有进展生存期。值得一提的是,即使没有基础,EGFR或MET29%的生物标志物患者仍在亚群中观察到ORR。这种支持策略可能被广泛使用。
另一个例子是靶向HER3抗体偶联药物patritumab deruxtecan。HER3表达通常在携带EGFR突变的耐药性肿瘤增加,抑制EGFR临床前模型可提高活性patritumab deruxtecan抗癌活性。Patritumab deruxtecan作为一种单一的药物,美国已经获得了FDA授予的突破性疗法用于治疗第三代酪氨酸激酶抑制剂和含铂治疗后的疾病进展和耐药性EGFR突变的转移性或局部晚期NSCLC病人。这些证据支持探索和探索。patritumab deruxtecan与第三代EGFR抑制剂联合使用的效果。
其他创新的治疗策略,包括癌症疫苗,也有望治疗EGFR和ALK驱动的NSCLC病人。一个基础DNA的ALK疫苗已经在小鼠身上了ALK驱动淋巴瘤和NSCLC为了探索抗抗免疫反应,在模型中激发强免疫反应ALK疫苗作为一种创新的治疗策略奠定了基础。个性化新抗原疫苗作为单一药物,或与单一药物相结合。EGFR抑制剂联合使用,现在也在早期临床试验中接受检验。
作者指出,激活性EGFR突变和ALK重排的发现是治疗NSCLC它带来了范式的变化。然而,耐药性仍然是一个未完全解决的挑战。目前,基础、转型和临床研究的合作将提供TKI对耐药性癌症生物学有更深入、更广泛的机制理解,使理性开发创新疗法成为可能。
参考资料
[1] Cooper et al.,(2022),Third-generation EGFR and ALK inhibitors: mechanisms of resistance and management. Nat Rev Clin Oncol,https://doi.org/10.1038/s41571-022-00639-9
