70万天价药降至3.3万!医疗保险中有40多种罕见病药物
2月28日是国际罕见病日,中国现有罕见病患者超过2000万人,每年新增20多万人。世界上已经确认了7000多种罕见病,并以每年250到280种的速度增长。世界人口基数巨大,罕见病并不罕见。最近,中国血友病患者呼吁罗氏艾美赛珠单抗降价引起了激烈的讨论。目前,国内罕见病的治疗大多依赖于进口药物。据统计,已有40多种罕见病药物被列入医疗保险目录,跨国制药公司聚集在一起,国内制药公司赶上。到目前为止,国内制药公司开发的药物已经获得FDA大约有100项资格被授予孤儿药物。其中,信达生物、恒瑞医药、复星医药、石药集团等国内医药巨头众多,北海康成依托License-in模式不断壮大。
天价药降至370万.3万!40多种罕见病药物进入医疗保险
近日,一封关于中国血友病患者罗氏制药的公开信引发热议。信中指出,罗氏治疗血友病A艾美赛珠单抗注射液上市以来,罕见病药物价格一直居高不下,血友病患者呼吁罗氏降价。
据统计,目前国内已批准上市罕见病药物60余种,其中40余种被列入国家医疗保险药品目录,涉及25种疾病。其中,医疗保险中包括多发性硬化、肺动脉高压、帕金森病(青年型、早发型)和血友病的药物相对较多,均超过5种。
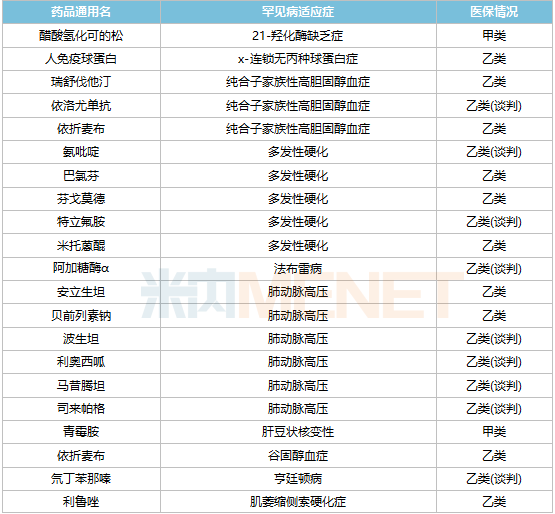
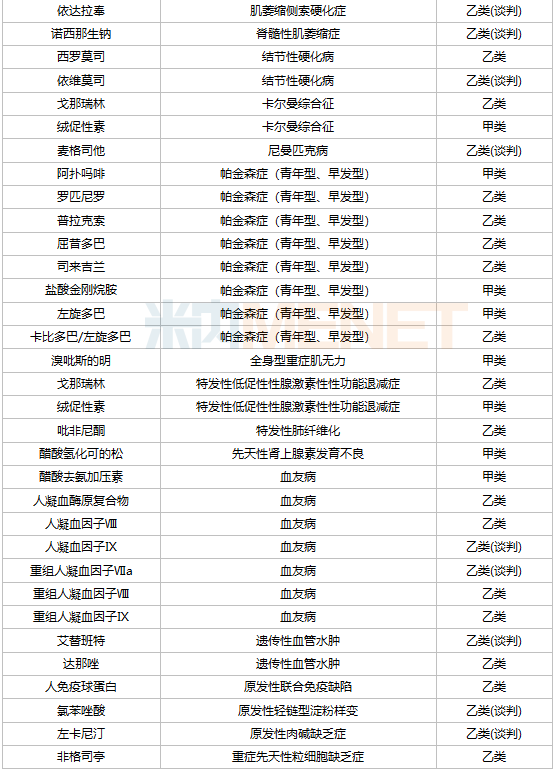
罕见病药物进入医疗保险目录是降价的主要途径之一。2021年,首次通过医疗保险谈判进入医疗保险目录的罕见病品种有7种,包括依洛尤单抗注射液、诺西那生钠注射液和人凝血因子Ⅸ、阿加糖酶α注射用浓溶液、氯苯唑酸软胶囊、醋酸艾替班特注射液和氨吡啶缓释片。其中,诺西那生钠注射液是第一种被列入国家医疗保险目录的高价值罕见病药物。这种治疗脊髓型肌萎缩症的药物价格一度高达70万元/针,2021年为3.3万元/针成功通过医保谈判,降价高达95%。
超过100亿市场群雄!国内药企奋起直追
数据显示,预计2022年中国罕见病市场将有24亿美元(约152亿元),2030年将增至259亿美元(约1642亿元)。市场增长显著,前景广阔。随着近年来罕见病市场的持续升温,越来越多的企业瞄准中国市场。
目前,我国罕见病药品主要依靠进口药品,跨国制药企业纷纷在此攻城掠地。自2018年以来,80%以上的罕见病药品都是进口药品。赛诺菲、罗氏、武田、渤健等都是国内罕见病市场的老面孔。阿斯利康于2020年底收购了罕见病制药公司Alexion之后,它也正式进入了罕见病领域。与此同时,跨国制药公司正在逐步增加罕见病领域的业务比例。例如,辉瑞在去年年底重新调整了中国的组织结构,罕见病被列为六个独立部门之一;2021年9月,阿斯利康宣布正式成立中国罕见病业务部。
而国内药企则奋起直追。截至目前,国内药企开发的药品已获得FDA孤儿药资格约100项,涉及50多家制药企业。其中,信达生物、恒瑞医药、复星医药、石药集团等国内医药巨头众多,北海康成依托License-in模式不断壮大。
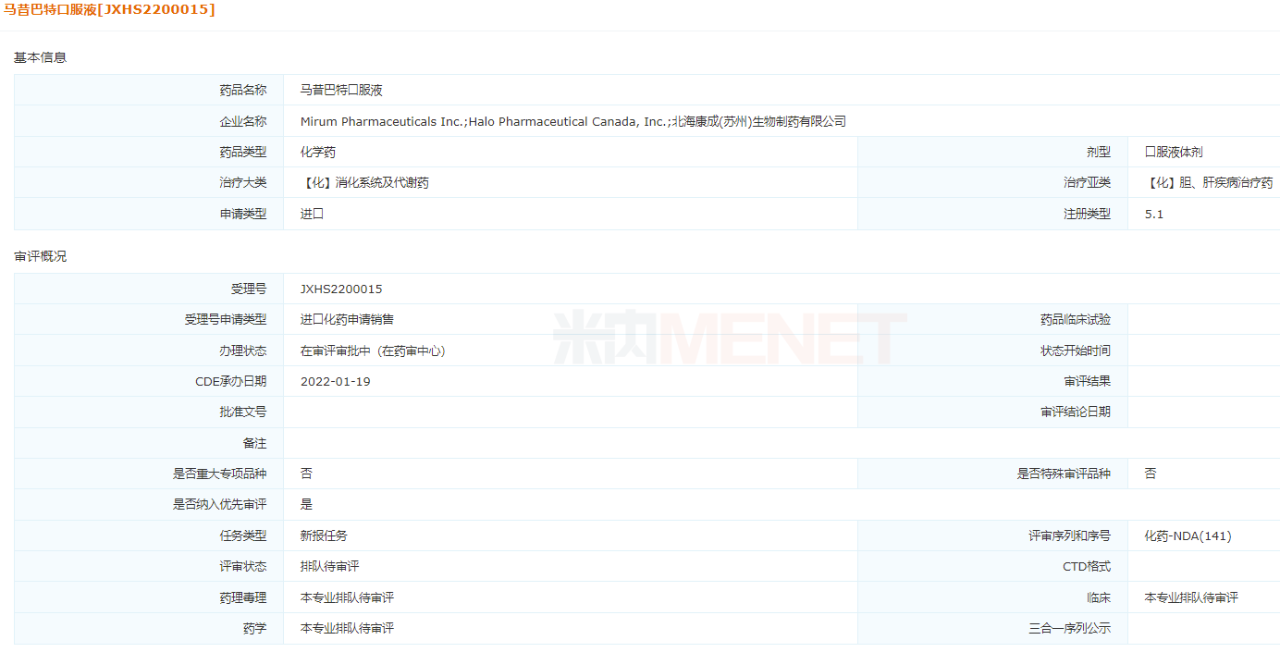
今年1月,北海康成罕见病药物马昔巴特口服液申报上市,因符合儿童生理特征的新品种、剂型、规格计划优先考虑,1岁以上Alagille综合征(ALGS)患者胆汁淤积性瘙痒。马昔巴特口服液于2021年9月在美国获批上市,是世界上第一个也是唯一一种治疗方法ALGS罕见病药物。2021年4月,北海康成和原研厂家Mirum达成合作,在大中华区获得针对性ALGS、进行性家族性肝内胆汁淤积、胆管闭锁开发和商业化马昔巴特的独家授权。针对家族性肝内胆汁淤积和胆管闭锁开发。ALGS我国尚未推出适应症治疗药物,北海康成有望凭借马昔巴特口服液在罕见病领域占据领先地位。
值得一提的是,马昔巴特口服液并非北海康成License-in唯一的案例,相反,北海康成可以算是License-in模式的老兵。成立10年来,北海康成有3款产品获批上市,均从国外引进。康普舒,预防和治疗化疗引起的口腔黏膜炎,从英国引进EUSA制药公司;用于HER2阳性早期乳腺癌强化辅助治疗的奈拉替尼从美国引进Puma生物技术公司;以及中国第一家粘多糖储积症Ⅱ海瑞思(艾度硫酸酯酶酶替代疗法)β),引进自韩国GC Pharma公司。
从研究品种来看,除了申请上市的马昔巴特口服液外,北海康成还有3种产品处于临床阶段,另外3种产品处于临床前阶段。其中,其核心产品是CAN008(Asunercept)。CAN008是胶质母细胞瘤的正开发(GBM)的CD95-Fc糖基化融合蛋白目前在中国II临床试验阶段。据了解,CAN008是来自Apogenix公司于2015年6月由北海康成引进中国。
由于受众范围于受众范围狭窄,收入不确定,前期研发难度较大。北海康成利用License-in路径,与自己的产品研发形成丰富的产品管道,弥补自己产品管道的不足。此外,这种模式的成功使用为企业带来了可观的回报。2021年12月,北海康成功在香港上市。
亚盛、石药、百济神州……扬帆出海
在国外,罕见病药物通常被称为孤儿药物。为了激发企业研发孤儿药物的动力,30年前美国颁布的《孤儿药物法案》可以享受临床试验费用的税收减免NDA申请费、获得研发资助、美国市场7年独占权等红利至今有效。对于国内制药公司来说,药于药品。FDA获得孤儿药的资格是对自身研发实力的认可。通过中美双报的红利,药品可以抓住国内市场的机遇。更重要的是,孤儿药资格认定可以成为新药进入美国市场的垫脚石,也是中国创新药走向国际化的捷径。
2月14日,信达生物与驯鹿医疗联合开发靶向B细胞成熟抗原(BCMA)自体嵌合抗原受体T细胞(CAR-T)的创新药IBI326,获得美国FDA被授予的孤儿药资格主要用于治疗复发性/难治性多发性骨髓瘤,这是信达生物获得的第二个FDA具有孤儿药资格的药物。
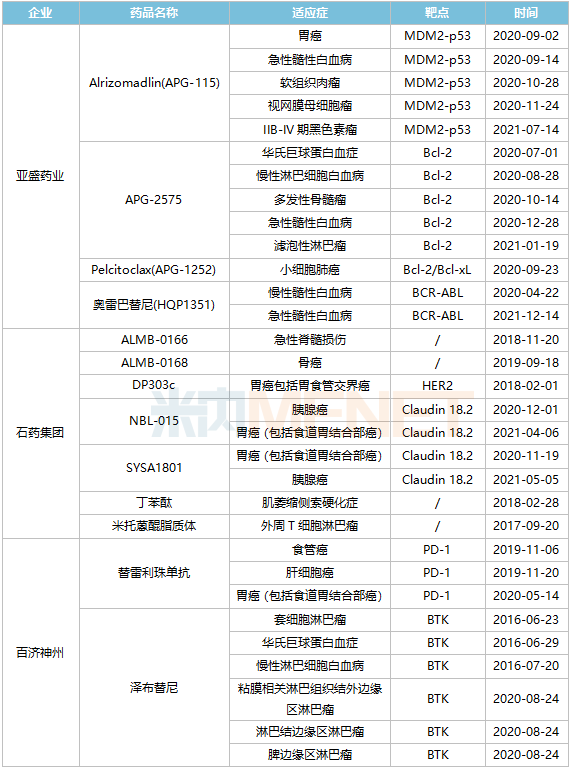
从获FDA从孤儿药资格数量来看,亚盛药业、石药集团、百济神州走在前列。亚盛药业共有4种研究药物,共有13种FDA获得的孤儿药资格证书继续刷新中国制药公司的记录,成为中国孤儿药管道的领导者;石药集团拥有7种研究药物,共9种孤儿药资格证书;百济神州还获得了9种孤儿药资格证书,替雷利珠单抗和泽布替尼。
亚盛药业第三代BCR-ABL2021年11月获得抑制剂奥雷巴替尼NMPA批准上市,用于治疗任何酪氨酸激酶抑制剂(TKI)耐药性和充分验证的检测方法被诊断为伴随性T315I慢性髓细胞白血病突变(CML)慢性期(CP)或加速期(AP)成年病人。目前,奥雷巴替尼已在美国获得两项孤儿药治疗慢性髓性白血病和急性髓性白血病的资格。BCR-ABL抑制剂格列卫(伊马替尼)是奥雷巴替尼商业价值的重要参考。米内网络数据显示,2020年,中国城市公立医院、县级公立医院、城市社区中心和乡镇卫生中心(以下简称中国公立医疗机构)终端伊马替尼销售额超过20亿元。
2022年1月,石药集团米托醌脂质体在中国获批上市,用于治疗复发或难治的外周T细胞淋巴瘤(PTCL)。在美国,米托醌脂质体也接受外周治疗T细胞淋巴瘤孤儿药物资格。此外,石药集团丁苯酞软胶囊于2005年在中国上市,2020年在中国公立医疗机构终端丁苯酞销售额突破60亿元,2017年获得肌萎缩侧索硬化孤儿药物治疗资格,石药集团将中国一种新药推向国际市场。
百济神州的替雷利珠单抗和泽布替尼都是中国批准的重药。替雷利珠单抗是中国第六款上市的单抗。PD-1.目前,替雷利珠单抗已获得食管癌、肝细胞癌、胃癌(包括食管胃结合部癌)三种孤儿药物资格。泽布替尼是第一个在美国获批上市的国内抗癌药物,创造了历史。2022年2月23日,泽布替尼新适应症上市申请在美国获得FDA接受。目前,泽布替尼已获得6项孤儿药资格,是国内药企获得孤儿药资格最多的药物。
