NMPA最新报告:中国创新药的发展趋势
文章来源:医药魔方Pro
作者:白露
随着过去10年监管体制改革的重大变化,我国新药的临床开发和监管审查发生了重大变化。这些改革旨在鼓励创新药物的开发,特别是对罕见、严重或危及生命的疾病,以确保患者能够及时得到治疗。
为了评价改进效果,北京大学临床药理研究所所长崔一民博士和NMPA药品评价中心副主任王涛及相关研究人员分析了2010年至2020年中国批准的创新药物IND和NDA申请数据,相关结果于5月5日公布Nature Reviews Drug Discovery上。
首次IND申请数量急剧增加
从2010年到2020年,共提交636种创新药IND申请平均年增长率为32%(图1)。其中,1410种药物(86%)来自689家国内公司。值得注意的是,与2016年相比,2017年首次创新药物IND申请人数增加了78%,其中化学品和治疗生物制品分别增加了60%和159%。
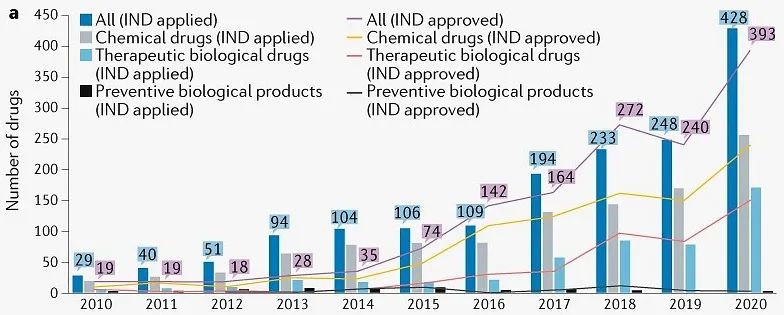
图1 | 创新药IND申请年度数量。根据药物类型,这些药物分为三类。(来源:Nature Reviews Drug Discovery)
1466项首次完成IND在审查中,1404项(96%)获得批准。被拒绝的主要原因包括:申请后缺乏研究信息导致沟通不畅、药物临床效益风险比不合理、违反临床诊断基本原则等。
第一次创新药IND申请和批准的数量显著增加,其中首次批准的数量显著增加IND创新药物数量以每年35%的速度增长。这与2015年7月中国监管改革措施出台的时间一致,说明有效缓解了申请积压,鼓励了药物创新。
创新药物的NDA批准数量较少,但正在增长
2010从2020年到2020年,提交了101种创新药NDA申请,其中58种创新药获批。近年来,提交和批准的。NDA总体而言,数量仍保持增长趋势(图2),特别是自2015年7月以来,已批准创新药42种(72%)。
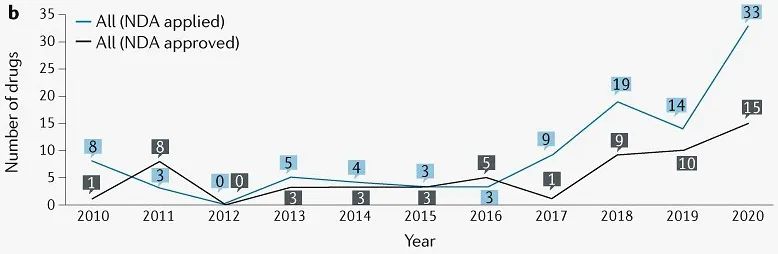
图2 | 创新药物NDA申请年度数量。(来源:Nature Reviews Drug Discovery)
第一次完成66项NDA在审查中,58项(88%)获得批准。不批准的主要原因是药物或临床研究设计的主要缺陷,不同开发阶段使用的研究样本不一致,检查中发现的临床试验数据不真实。
在58种获批创新药中,37种是中国NMPA批准的新分子实体(NME),21一种是在国外批准或销售的药物,包括传统疫苗、血液制品、细胞因子等。14种(24%)是孤儿药,其中13种符合美国要求FDA孤儿药标准。此外,40种创新药物(69%)获得优先考核,其中35种(88%)获得2015年7月以后批准。这些数据表明,2015年8月推出的优先考核等监管改革措施鼓励制药企业创新。
肿瘤是创新药物的主要领域,大多处于早期开发阶段
首次IND肿瘤(864、62%)、感染(166、12%)、内分泌疾病(72、5%)和心血管疾病(60、4%)是申请批准创新药物的主要治疗领域。2016年,首次IND申请批准的肿瘤药物数量显著增加,增长率为133%(图3)。
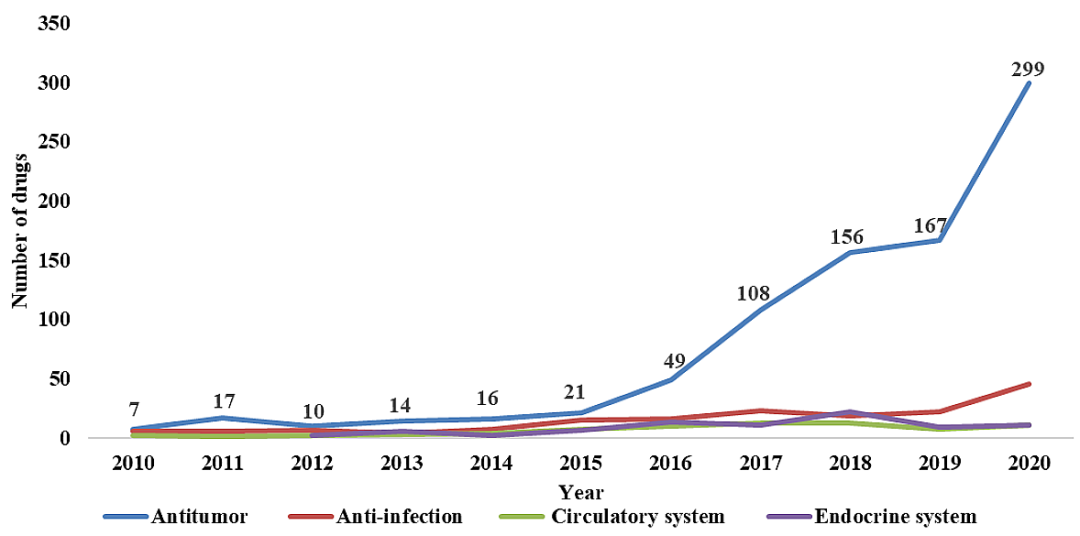
图3 | 2010–20202000年,我国创新药物不同治疗领域的趋势。治疗领域根据产品首次批准的适应症进行分类。(来源:Nature Reviews Drug Discovery)
在首次IND至少请批准的创新药中,至少有705种(50%)I期研究阶段,分别达到286(20%)和108(8%)药物II期和III研究阶段。然而,大多数抗癌药物(57%)尚未完成I期研究(图4a)。

图4 | 创新药开发概况。a)主要治疗领域;b)药物靶点。药物可以针对单个靶点或多个靶点。(来源:Nature Reviews Drug Discovery)
中国主要处于快速跟进和逐步创新阶段。目前,只有三个阶段NDA批准的创新药物是first-in-class,它们是:本维莫德、甘露特钠和罗沙司他。EGFR、PDL1和HER2有40多种药物(图)4b),其中靶向EGFR临床试验阶段批准的药物(4)和药物(64)最多。然而,值得注意的是,多种药物集中在相同的靶点和适应症会降低新药创新的效率。
IND和NDA批准效率加快,但临床试验速度没有提高
如图5所示,改革后(2015年7月)–2020年12月)的IND批准时间比改革前(2010年1月)–20152006年6月)缩短414天(分别为87天和501天)。同样,与改革前相比,改革后药如此。NDA批准时间缩短了441天(分别为924天和483天)。

图5 | 2010-2020年度创新药批准时间长度。(来源:Nature Reviews Drug Discovery)
2018年7月,NMPA将药物临床试验的批准程序调整为默示许可证制度。就整个临床试验阶段的时间长度而言,这两个过程的差异并不明显(分别为2572天和2688天),改革后,IND第一个受试者参加临床试验的时间比改革前多59天(分别为328天和269天)(图5)。
提高临床试验效率是我国鼓励创新的重要改革方向。然而,这受到伦理审查效率、研究人员经验和临床试验资源等诸多因素的影响。此外,目前靶点和适应症相同的药物集中在同一临床试验阶段,加剧了对临床试验效率的影响。要解决这些问题,我们需要战略性地提高我国的临床试验能力。
-----
总的来说,中国的监管改革促进了国内的医疗创新。经批准。IND和NDA这些批准的数量和时间趋势表明,改革的影响总体上是有益的。然而,同一靶点产品的重复和低效的临床试验过程将影响真正有意义的创新药物IND到NDA审批进展。

