上市日有多远?复星医药mRNA新冠疫苗Ⅱ临床试验延长至今年10月底
综合整理 | haon
2022医药行业最大的悬案之一,复必泰大陆何时上市?
等一等,复星医药握在手里两年mRNA新冠疫苗在内地上市的日子似乎更远了。
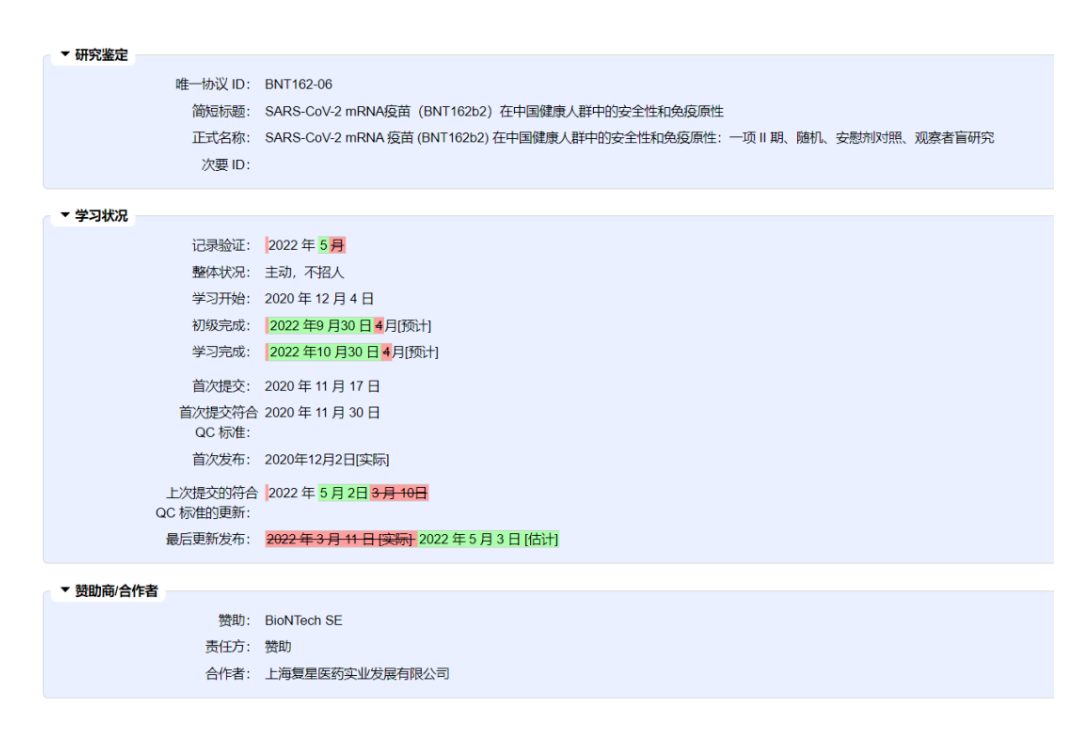
日前,根据日前,mRNA福星情报局 报道,国际临床试验数据库信息显示(此测试信息由德国制药公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司公司Biontech注册维护),复星医药引进Biontech的mRNA新冠疫苗-复必泰(BNT162b2)中国Ⅱ期临床试验结束日期延长至2022年10月30日(预计)。
原试验计划的结束日期为2021年12月,此前已延长至2022年4月30日,现在又延长了。
这意味着,如果国家食品药品监督管理局想要在复必泰Ⅱ临床试验结束后,复必泰的上市日期至少要等到今年11月(假设计算,或有其他可能)。
01
一直在审批的复必泰
2020年3月以来,复星医药早于辉瑞引进Biotech的mRNA新冠疫苗已经过去两年了。
依靠辉瑞Comirnaty赚大钱的时候(2021年营收367.8亿美元,2022Q1营收132.3目前,复必泰仅在香港、澳门和台湾投入使用。凭借这三个地区的销售额,2021年实现了超过10亿元的规模。
虽然复必泰已成为复星医药收入超过10亿的三大龙头产品之一,但与辉瑞近500亿美元的销售业绩相差甚远。
因此,复必泰何时获批在内地上市,开拓更大的市场空间?一直是业界关注的焦点。
在此之前,一点风吹草动都能引发市场对复必泰获批的联想,复星医药也多次表示,已经为复必泰上市,随时准备待命——
20202012年12月,复星医药在提交复必泰上市申请后不久,立即购买了1亿剂疫苗,表现出极大的信心。目前,港澳台已接种复必泰超2200万剂。
20212005年5月,复星BioNTech宣布在中国设立合资企业,进行复必泰的本地生产和商业化。
20217月,复星医药董事长兼复星医药董事长CEO吴以芳在股东大会上回复投资者询问时表示,国家食品药品监督管理局对福必泰的审批工作已基本完成,专家评审已通过。正在加强行政审批阶段。当时,业内普遍认为福必泰即将上市。
然而,很长一段时间没有,然后很长一段时间没有……
20222003年3月,上海发布了一则关于支持新冠疫苗进口的消息。如此好的春风,让复必泰再次成为焦点。
20222003年3月,吴以芳在复星医药的最新业绩会议上保守地说:复必泰大陆的上市仍在审批过程中,目前还没有更多的消息。在其他方面,它处于待命状态。
据悉——
在供应问题上,复星医药曾表示,复必泰疫苗一旦获批,就可以在第一时间供应到中国。
在储存和运输条件方面,由于复必泰需要在零下70度储存,复星医药已经建立了零下70摄氏度的冷藏室,疫苗可以在2到8度的环境中储存5天。基层疫苗接种点还将配备冰箱,在数量、价格等方面不构成可及性障碍。
在营销推广方面,复星医药早已开始招聘mRNA疫苗相关销售人员。
……
然而,尽管市场期待,复星医药随时待命,复必泰上市的消息仍未能等待。
02
复必泰Ⅱ为什么临床试验一再延期结束?
复星医药执行总裁、全球研发中心总裁兼首席医学官回爱民博士此前曾在复必泰中国II临床试验启动会介绍,Biontech最初有20多种临床前新冠候选疫苗,其中包括BNT62b1和BNT162b2两种疫苗的免疫原性和安全性最好。
一开始,复星医药选择了最完整的疫苗数据BNT162b1在国内开展I期临床试验。然后,,,BNT162b2经过国外临床试验,发现优势更大。随后,复星医药在中国申报并进行。Ⅱ临床试验也改为期BNT162b2。
根据全球第III期临床试验结果显示,BNT162b2已达到所有主要疗效终点,预防新冠病毒感染的有效性为95%,对65岁以上成年人的有效性超过94%,优势明显。
此外,由于BNT162b2疫苗已在国外完成III临床期只需在中国完成Ⅱ期临床试验,以此为桥接试验,与国外一起获得III临床试验数据可在国内申请上市。
然而,一次又一次的拖延,目前,一次又一次的拖延,BNT162b2疫苗在中国Ⅱ临床试验结束日期再次延长。
对于延期的原因,有业内人士告诉新浪医药,可能是出于延期,BNT162b2国内Ⅱ期与国外III临床试验数据的桥接问题。
未来,复必泰何时能在中国完成?Ⅱ期临床试验?
在沃森生物-艾博生物、斯微生物、艾美疫苗、瑞博生物-阿格纳生物、中生复诺健、瑞科吉生物、威斯津生物、康希诺、石药集团、蓝鹊生物等国内制药企业主导研发mRNA随着新冠疫苗的加速,早早上车的复必泰能否成为内地首个上市的复必泰?mRNA新冠疫苗?新浪医药将继续关注。
附·BNT162b2在中国Ⅱ临床试验具体信息:
试验名称:SARS-CoV-2 mRNA 疫苗 ( BNT162b2 ) 在中国健康人群中的安全性和免疫原性:II 期、随机、安慰剂对照、观察者盲法研究
Safety and Immunogenicity of SARS-CoV-2 mRNA Vaccine (BNT162b2) in Chinese Healthy Population: A Phase II,Randomized,Placebo-controlled,Observer-blinded Study
实验简介:这是一个关于实验简介的问题SARS-CoV-2信使RNA(mRNA)疫苗(BNT162b2)中国健康人群的安全性和免疫原性II期间、随机、安慰剂比较、观察者盲法研究。随机分组后,每个参与者的测试将持续约13个月。筛选期为随机分组前2周(第14天至第0天)和两剂SARS-CoV-2疫苗(BNT162b2)或者安慰剂在21天内注射肌肉(IM)
This is a phase II,randomized,placebo-controlled,observer-blinded study of the safety and immunogenicity of SARS-CoV-2 messenger RNA (mRNA) vaccine (BNT162b2) in Chinese healthy population. After randomization,the trial for each participant will last for approximately 13 months. Screening period is 2 weeks prior to randomization (Day -14 to Day 0),and two doses of either SARS-CoV-2 vaccine (BNT162b2) or placebo will be given intramuscularly (IM) separated by 21 days.
实际入组人数:950人
招聘年龄:18岁至85岁(成人、老人)
地点:中国江苏省疾病预防控制中心
责任方:BioNTech SE
合作伙伴:上海复星医药发展有限公司
参考资料:
1.mRNA福星情报局《复必泰疫苗,二期临床试验结束时间再次延长至2022年10月30日》
2.CC《复必泰疫苗将上市》情报局
3.财联社大量复星医药招聘专员 或负责mRNA新冠疫苗的销售和推广
