PD-1内卷严重?小分子笑而不语
作者:陈燚
免疫系统在控制和根除肿瘤方面发挥着重要作用,但肿瘤细胞通常可以避免或抑制免疫反应。从机制上讲,免疫细胞表达的共刺激和抑制分子表达和功能的变化是重要原因,PD-1蛋白质是关键分子之一,它与其配合PD-L1结合后,抑制免疫激活。考虑到。PD-L1/PD-1免疫系统可以通过药物干预破坏轴的关键作用来控制肿瘤。
靶向PD-L1或PD-1治疗性抗体已被证明是多种肿瘤的有效治疗方法,国内外已有10多种肿瘤PD-1/PD-L1免疫检查点抑制剂获批上市。在一系列临床前肿瘤模型中,PD-1/PD-L1抗体可以被阻断PD-L1/PD-1相互作用进而提高T细胞反应、诱导细胞因子和肿瘤细胞的细胞毒性作用,增加肿瘤反应性CD8 T细胞的增殖和渗透。
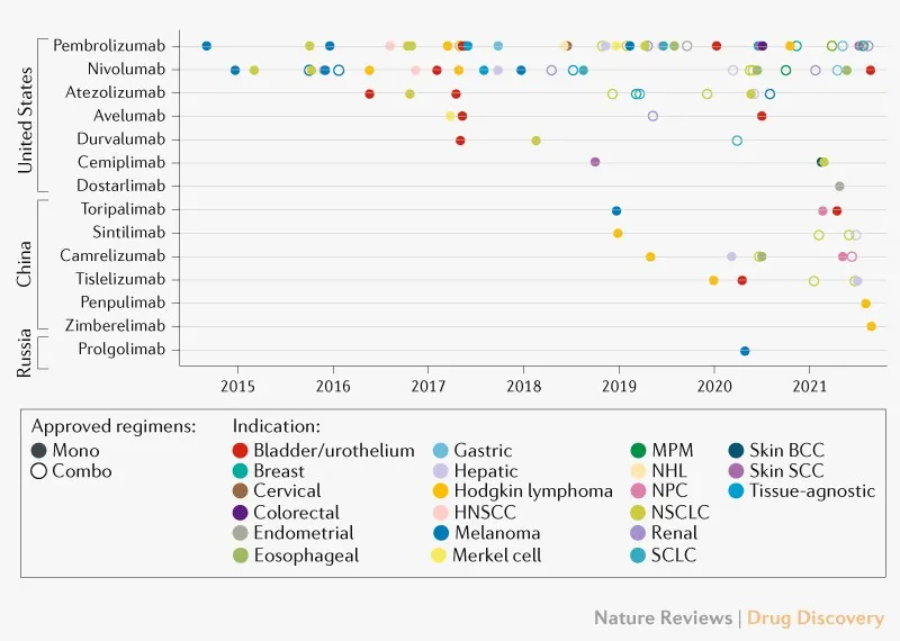
PD-1/PD-L1检查点抑制剂批准时间表
(来源:Nat Rev Drug Discov.[1] )
与治疗性抗体相比,小分子PD-L1/PD-1抑制剂具有独特的优点,其半衰期较短,可以灵活调整给药时间和剂量,最大限度地减少与免疫相关的不良事件,最大限度地提高收益/风险比。口服给药也可以更方便地作为单一疗法和与其他分子靶向药物联合给药。值得注意的是,这些药物的组织渗透性通常会增加,并有增强抗肿瘤活性的潜力。
随着PD-L1和PD-1深入研究晶体结构,PD-L1/PD-1相互作用界面的关键氨基酸(hot-spots)可用于指导小分子抑制剂的设计。提前揭示。PD-L1/PD-1小分子抑制剂的研究主要集中在肽基小分子化合物上Aurigene公司最具代表性。
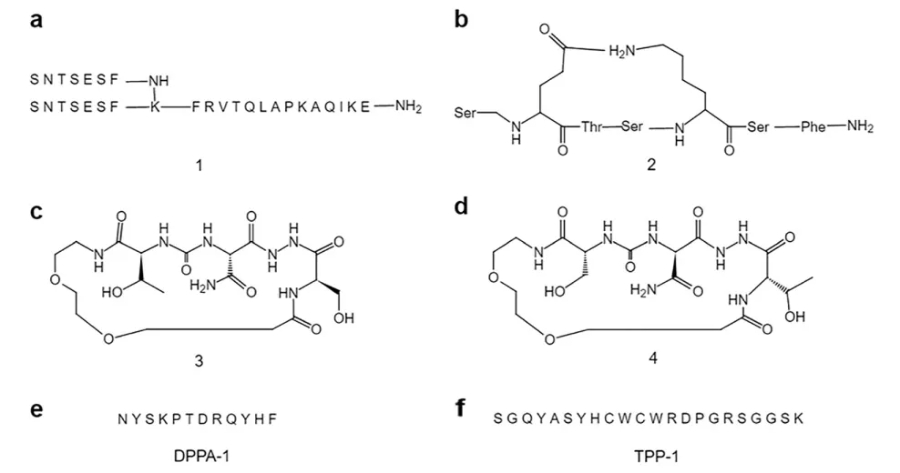
肽基PD-L1/PD-1小分子抑制剂
(图源:Acta Pharmacol Sin. [3])
2015年,BMS公司开始关注非肽PD-L1/PD-1小分子抑制剂的开发,然后是Incyte和Polaris公司相继加入此行列,相应的候选化合物也进入了早期临床阶段。近两年来,国内制药企业逐步布局小分子PD-L1/PD-1抑制剂管道进一步加剧PD-L1/PD-1肿瘤免疫靶点的竞争。FDA经批准的抗蛔虫药吡维胺吡维胺(pyrvinium)也被报道对PD-L1/PD-1相互作用有抑制作用,但活性较弱,可作为PD-L1/PD-1进一步优化小分子抑制剂先导化合物的结构,以提高其活性。然而,在该领域仍处于早期阶段,文献仅限于临床前化合物筛选和活性评价,临床试验数据很少。
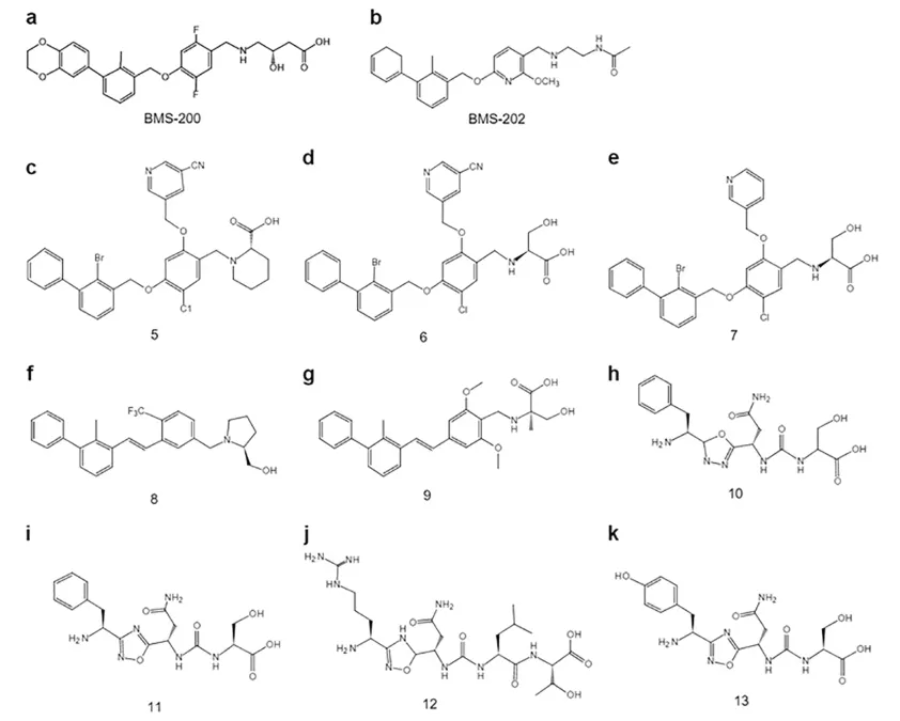
非肽类PD-L1/PD-1小分子抑制剂
(图源:Acta Pharmacol Sin. [3])
2022年3月7日,Incyte研究人员在这里《Cancer Discovery》杂志报道了一种PD-L1小分子抑制剂——INCB086550,它具有与PD-L1/PD-1单克隆抗体相似的生物学特性可能代表抗体治疗的替代方案。在体外,INCB086550选择性阻断PD-L1/PD-1相互作用,诱导PD-L1二聚化和内化,诱导原代人体免疫细胞中依赖性细胞因子的产生。在体内,INCB086550抑制CD34 人源化小鼠肿瘤生长,通过阻断PD-L1/PD-1通路诱导T细胞活化。患者的初步临床数据证实了外周血细胞中的外周血细胞。PD-L1/PD-1随着免疫激活和肿瘤生长控制长控制(NCT03762447)。这些数据支持继续临床评估INCB086550作为抗体治疗的替代品。

图源:Cancer Discovery
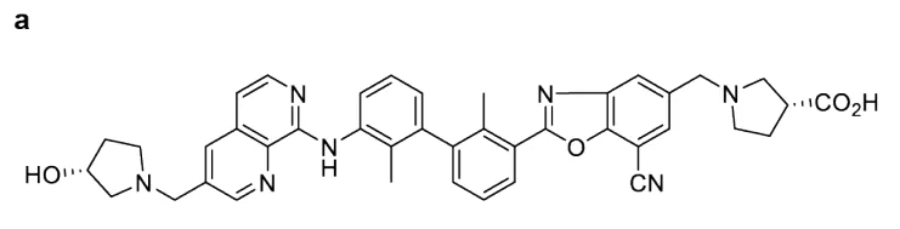
INCB086550结构
基于HTRF的PD-L1/PD-1结合实验检测发现分子水平,INCB086550可与人源、蟹猴、大鼠源相结合PD-L1蛋白质,但和小鼠源PD-L1蛋白质结合能力弱(蛋白氨基酸序列差异)。与之相比。PD-L2结合能力弱,说明INCB086550对PD-L1选择性。细胞水平活性检测发现,INCB086550可以阻断PD-1蛋白与CHO细胞表面PD-L1蛋白质的结合。与此同时,INCB086550还能阻断anti-PD-L1单抗atezolizumab和durvalumab对PD-L1结合,表明INCB086550和anti-PD-L1单抗竞争结合点。

小分子PD-L1抑制剂INCB086550的活性数据
然后,研究人员用各种抗体来表征INCB086550诱导PD-L1二聚体的形成和内化的影响。anti-PD-L1抗体克隆MIH1与INCB086550竞争性地与CHO细胞表面的PD-L1蛋白质结合,克隆28-8没有这种效果。因此,克隆。28-8可用于检测细胞表面总表面PD-L1蛋白,克隆MIH1结合可反映抗原表位的阻断作用。采用克隆28-8流式检测发现,INCB086550能减少细胞表面的PD-L1达70%;克隆MIH1的检测表明
