6国内实体瘤CAR-T疗法进展如何?
20212000年,复星医药阿基仑赛注射液和药明巨诺瑞基奥仑赛注射液相继在中国上市,CAR-T产品在中国实现了破冰,但这两种产品都是针对血液瘤的。同时,我国大部分产品已进入临床阶段CAR-T治疗也布局在血液瘤领域,事实上,2021年最新的全球癌症数据显示,约90%的癌症发病率是由实体瘤引起的,因此CAR-T实体瘤治疗可以说是目前市场关注的方向之一。
国内科济药业、斯丹赛、博生吉、传奇生物等企业均在布局中CAR-T实体瘤治疗已经或正在进入临床试验阶段。
1、科济药业
科济药业无疑是国内实体瘤CAR-T事实上,体瘤管道布局最多、进展最快的企业实际上是体瘤CAR-T疗法包括:
CT041——靶向CLDN18.2蛋白的自体CAR-T细胞候选产品适用于治疗CLDN18.2阳性实体瘤主要治疗胃癌/食管胃结合部腺癌(GC/GEJ)及胰腺癌(PC),它是世界上唯一获得美国的美国FDA中国食品药品监督管理局和加拿大卫生部IND/CTA目标批准并正在进行临床试验研究CLDN18.2的CAR-T细胞候选产品。今年3月,CT041在北京大学肿瘤医院完成中国确证Ⅱ首例临床试验患者入组,主要治疗过去至少二线治疗失败的患者Claudin18.2(CLDN18.2)表达阳性晚期胃癌/食管胃结合部腺癌。科济药业计划于2024年上半年向中国国家食品药品监督管理局提交NDA,并计划于2022年下半年在北美启动二期临床试验,2024年向美国启动二期临床试验,2024年向美国启动FDA提交BLA。
CT011——潜在的全球同类首创CAR-T细胞候选产品产品)GPC3 CAR-T),治疗肝细胞癌(HCC)临床数据的概念验证已在中国完成I期试患者入组,预计2021年下半年启动II期试验。
CT0180——表达靶向GPC3抗体融合T细胞受体(aTCR)自体融合蛋白T细胞产品。临床研究表明,在小鼠异种移植模型中,CT0180能有效识别和杀死GPC3阳性肝细胞癌细胞大大抑制HCC肿瘤生长,体内外细胞因子释放低于GPC3 CAR-T细胞提高了过继性细胞疗法的安全性和适用性。
CT0181——靶向GPC3抗体融合T细胞受体共同表达IL-7细胞因子的自体T细胞产品。临床前研究表明,与。GPC3 CAR-T细胞相比,CT0181具有低细胞因子释放的实体瘤异种移植物具有优异的抗肿瘤作用,T细胞持久性和免疫记忆。

此外,科济药业还针对间皮素、GFR/EGFRvIII等的实体瘤CAR-T治疗正在研究中。
工业化方面,科济药业在上海和美国都有生产基地,有端对端颗粒、病毒载体和CAR-T细胞生产能力,能独立生产CAR-T细胞支持中国的临床试验和慢病毒载体的独立生产,以支持全球临床试验。其中,科济药业在张江金山基地GMP生产工厂获得了中国第一个CAR-T预计每年可支持多达2000名患者的名患者CAR-T治疗;在美国北卡罗来纳州RTP CGMP生产厂成功通过官方设施检查,每年为700名患者提供额外的自体CAR-T细胞产品产能。
2、斯丹赛
2022四月,斯丹赛宣布FDA目标已被授予GCC的自体CAR-T治疗产品GCC19CART快速通道资格。GCC19CART它是一种治疗复发难治转移型结直肠癌(R/R mCRC)实体肿瘤疗法专门设计用于靶向和去除鸟苷酸环化酶C(GCC)的癌细胞。GCC19CART我国研究人员发起的早期临床试验(IRB)35名晚期结直肠癌患者入组,在剂量爬坡实验中接受2X10^6的GCC19CART 8名细胞/公斤剂量患者中,观察到客观缓解率的50%。
斯丹赛计划于2022年年中在美国启动,旨在评估GCC19CART安全性、耐受性和有效性在复发性难治性转移性结直肠癌患者中I期临床试验。
3、博生吉
2022今年4月,博生吉开发的靶向发展B7-H3嵌合抗原受体(CAR)-T细胞注射液(研发代号:TAA06取得临床试验申请CDE用于治疗神经母细胞瘤。这也是获得的。CDE受理的首个B7-H3靶向的CAR-T细胞产品。
B7-H3正常人体组织表达水平较低,但胰腺癌、前列腺癌、卵巢癌、肺癌、透明细胞肾癌、骨肉瘤、尤文肉瘤、神经脑胶质瘤等恶性肿瘤表现异常高。据报道,TAA06在注射液的早期药效研究和安全评价中,取得了优异的数据。该产品已于2022年3月获得。FDA孤儿药物鉴定和罕见病鉴定。
同时,TAA06注射液也是博生吉申报的第一款针对实体瘤适应症的产品。目前,博生吉已建成约1万平方米,符合要求GMP全自动标准化CAR-T细胞生产基地,为CAR-T细胞药物的商业化奠定了基础。
4、传奇生物
国内靶向CLDN18.2的CAR-T在治疗中,传奇生物LB1908紧跟科济药业CT041。
LB1908纳米抗体抗体设计,确保对CLDN18.2具有很高的特异性。临床研究表明,LB1908 CAR抗原结合区域与CLDN18.2具有高亲和力的特异性结合。LB1908体外和体内(人类肿瘤移植小鼠模型)的抗肿瘤作用是靶标特异性的。LB1908仅对表达CLDN18.2细胞有细胞毒性,但对人类原代细胞或表达细胞有毒性Claudin 18.1细胞没有细胞毒性。临床研究中,LB1908细胞源性异种移植瘤(或CDX)胃肿瘤小鼠模型和CDX胰腺肿瘤小鼠模型显示出显著的抗肿瘤作用。


目前,这款CAR-T疗法已进入剂量递增I第一次临床试验接受最低剂量LB1908在治疗患者中,它表现出良好的安全性和初步的抗癌活性。
据悉,传奇生物计划在中国进一步扩大临床试验,并准备于2022年上半年在美提交IND申请。
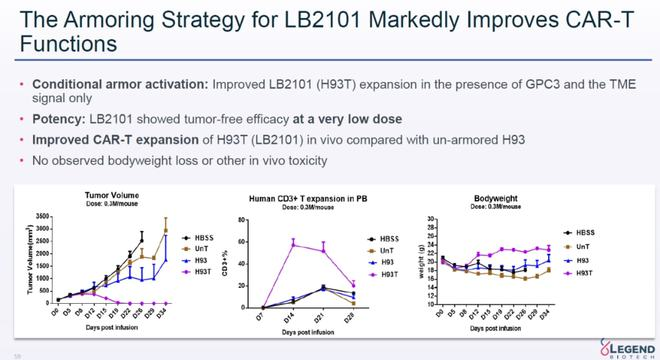
LB2101传奇生物靶向GPC-3的“武装”CAR-T疗法。它在表达靶向GPC-3嵌合抗原受体(CAR)此外,它还表达了肿瘤微环境中信号激活的跨膜蛋白。因此,它不会影响它。CAR-T细胞特异性还可以改善细胞的渗透、增殖和持久性。体外和体内的研究表明,LB2101无脱靶细胞毒性的肿瘤杀伤作用强。
5、重庆精准生物
20219月,重庆精准生物CAR-T产品C-4-29细胞制剂靶向治疗CD70表达阳性晚期肾细胞癌的适应症获得了临床试验的默示许可,这也是中国第一个针对肾细胞癌实体瘤的CAR-T产品。
据悉,CD70目标是国内重庆精准生物开发的创新目标,兼具血液和实体肿瘤的双重应用场景。C-4-29细胞制剂可用于治疗复发/难治性多发性骨髓瘤(MM)或晚期/转移性肾细胞癌(RCC)病人。第一个适应症(MM)2020年12月10日,临床试验通过了国家药品监督管理局药品价中心临床试验默示许可,并已启动I期临床研究。
6、信达生物
20222000年2月,信达生物宣布其研发的全球首个通用模块化抗紧密连接蛋白18.2(Claudin18.2)嵌合抗原受体T细胞注射液(研发代号:IBI345)在治疗晚期Claudin18.2在阳性实体瘤的临床试验中,完成了第一例患者给药。
据介绍,IBI345相较于传统CAR-T细胞的潜在优点包括:1)利用抗体的靶向标定作用,放大抗原靶点信号,引导抗原靶点信号CAR-T细胞进入肿瘤并启动识别和杀伤效应。2)调节抗体给药,调节抗体给药,调节抗体给药。CAR-T细胞活性,达到控制毒副作用的目的。3)模块化CAR-T具有通用性,可与不同抗体结合,通过序贯或同时给予以上针对不同抗原靶点的抗体,治疗抗原表达高度异质性的实体肿瘤或抗原缺失引起的肿瘤复发,有望成为实体肿瘤CAR-T在治疗上取得突破,减少CAR-T增加细胞治疗费用,增加患者CAR-T细胞治疗的可及性。
