CAR-T治疗贵在哪里?从制备过程和成本构成来解读
文 | 九思
导读:1989年Gross与同事提出嵌合抗原受体(Chimeric Antigen Receptor,CAR)他们将抗体抗原结合区的概念scFv与CD3-ζ链或FcεRIγ细胞内部融合形成嵌合抗原受体。随着科学技术研究的不断推进,目前,随着科学技术研究的不断推进,嵌合抗原受体已经形成。CAR-T疗法已经发展到第四代。虽然这种疗法在血液肿瘤治疗领域取得了长足的进步,但高昂的治疗成本也成为一个热门话题。去年在中国上市的两款CAR-T药物治疗费用分别为120万元(易凯达)和129万元(倍诺达),接下来笔者将对其进行梳理CAR-T制备工艺和成本构成,以窥探CAR-T治疗到底贵在哪里?
CAR-T疗法:是指通过基因克隆技术免疫球蛋白(Ig)抗原结合区T细胞受体进行基因改造,具有特异性抗原识别结构和T细胞激活信号的遗传物质转移到T细胞,使T细胞与肿瘤细胞表面的特异性抗原直接结合而被激活。CAR激活肿瘤抗原后,激活肿瘤抗原T细胞免疫通路,相关基因表达,分泌颗粒酶、穿孔素等物质直接导致肿瘤细胞溶解,同时分泌颗粒细胞巨噬细胞聚集刺激因子(GM-CSF)、干扰素-γ(IFNγ)等炎症因子,招募巨噬细胞等固有免疫细胞对肿瘤组织进行反应,从而治疗癌症。
CAR分子结构:CAR单链抗体主要识别肿瘤特异性抗原(scFV)段、铰链区和跨膜段,共刺激分子结构区,CD3ζ结构域构成。通过编码。CAR的基因引入T细胞,从第一代开始CAR-T细胞发展到第四代CAR-T细胞经历了30年的发育。
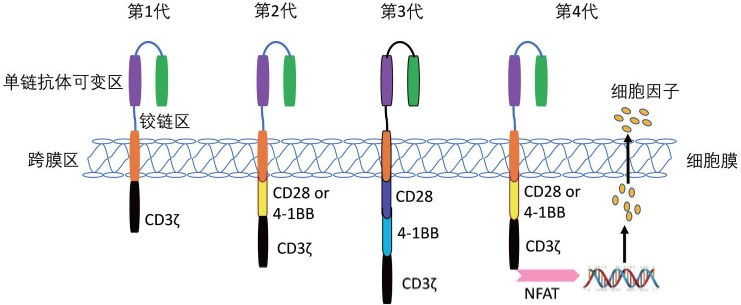
图1 CAR-T细胞结构演变
表1 四代CAR-T细胞结构的发展
01
CAR-T制备工艺复杂,耗时长
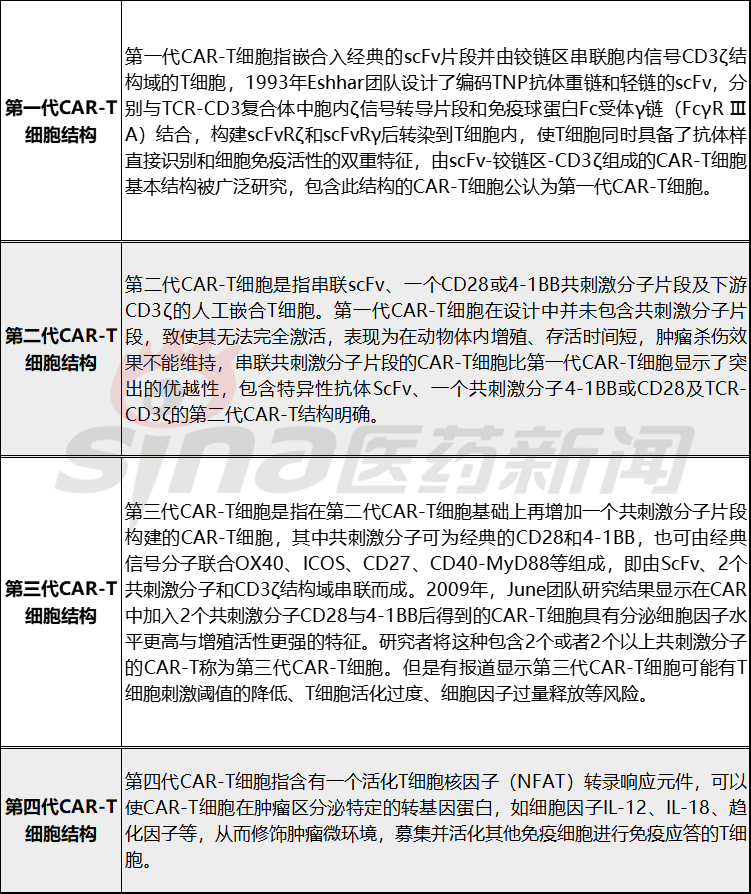
目前上市的CAR-T产品均为自体细胞来源,自体细胞来源CAR-T首先,准备患者的白细胞(WBCs)通过血细胞去除法分离后的洗涤获得。然后,,T细胞被激活和转导CAR将基因扩展到一定数量后,用于罐装和密封治疗。CAR-T细胞制备主要包括以下步骤:
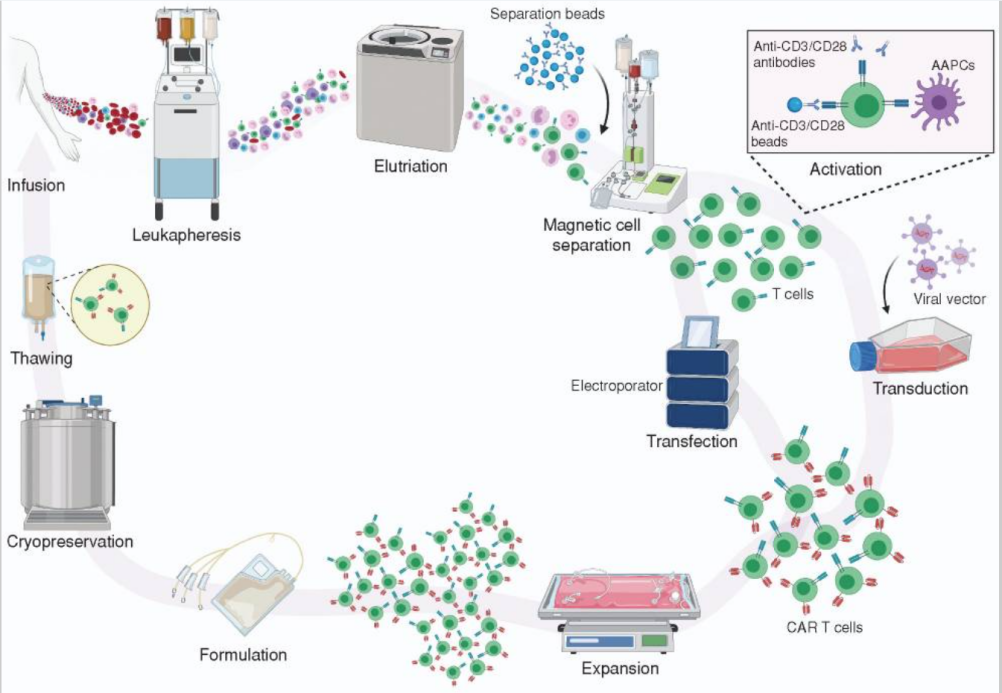
图2 临床规模自体CAR-T制备细胞疗法的过程
(1)清洁白细胞和细胞
在CAR-T在治疗过程中,患者的白细胞需要从体内提取,然后进行改造,使其表达CAR-T,然后输回病人体内。由于白细胞的重量不同于其他血液成分,常用的血液成分分离器包括:Trima、UVAR-XTS、COBE Spectra,然后洗去除白细胞分离过程中添加的抗凝剂。
(2)富集T细胞并激活
生产CAR-T时所用的T细胞富集法一般是单抗磁珠富集法,T细胞通过CD4/CD8分离特异性抗体或表面标记的偶联磁珠,然后加入特异性抗体或表面标记CD3/CD28单克隆抗体磁珠或人工抗原提成细胞等细胞培养基T细胞激活,这实际上是在正常的身体环境中模拟树状细胞休眠T刺激细胞并迅速激活细胞。因为只有活化的。T细胞能迅速分裂,而且细胞能迅速分裂,T细胞只有在活化后才能为特定的抗原分泌大量的抗体。
(3)基因传递/转染
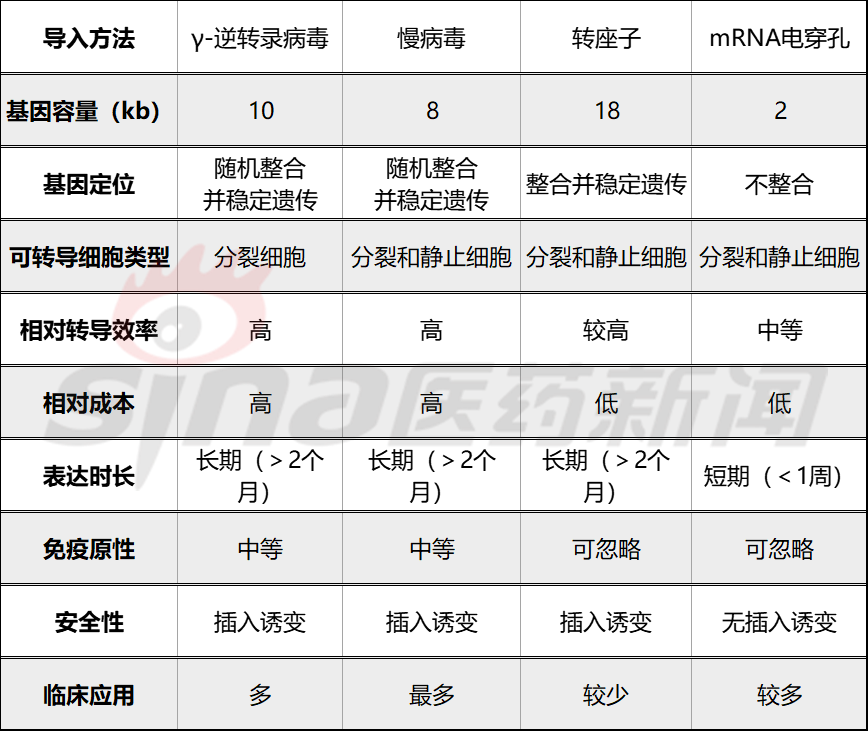
这是制备CAR-T关键是使用慢病毒/逆转录病毒载体或非病毒方法(电转录病毒载体)DNA、转座子/转座子系统CAR转染到T细胞中,CAR基因是T细胞准确识别肿瘤细胞的眼睛CAR-T产品的成本和质量。理想的载体应具有基因转染效率高、稳定性好、不引起免疫反应等特点。目前,临床试验主要是病毒载体转化。
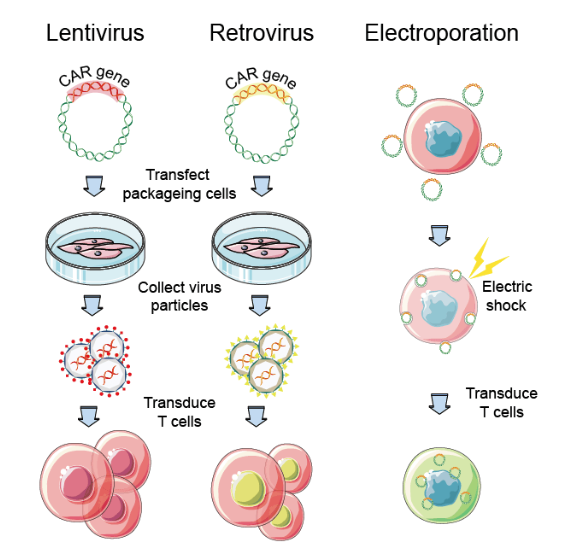
图3 CAR导入基因的主要方式
γ-逆转录病毒载体是人类第一个基因转导系统,临床应用没有与基因插入诱导相关的不良反应,属于一种RNA病毒。首先需要包装包装。CAR基因序列和LTR序列、gag和pol基因系列、env基因系列细胞的细胞器复制/转录病毒蛋白和所需的基因序列,将基因系列中的三个宿主细胞的细胞器中,并包装成携带CAR基因的γ-逆转录病毒载体。载体和活化载体。T细胞膜融合后释放CAR基因沿微管运输到细胞核(由于核膜损伤),并整合到细胞核中T细胞基因组后进行转录表达CAR蛋白。
慢性病毒载体相对γ-逆转录病毒转移质量较高,临床应用最广泛,但由于随机整合,仍存在一定的安全风险;慢性病毒载体具有更高的传输效率和T细胞转导质量,慢性病毒感染CAR-T它表现出更显著的抗肿瘤作用,是目前主流的输送载体,转染过程与逆转录病毒相似。静态和活化的可转导和活化T细胞,转移效率接近100%,转基因负荷可达8kb,基因毒性较小,整合点较小γ-逆转录病毒更安全,但成本更高。
绝大多数CAR-T细胞CAR转染是基于病毒载体的,但病毒载体的制造过程复杂,成本昂贵,控制严格。在临床试验的早期阶段,病毒载体难以满足要求GMP(药品质量管理规范)的各个方面。因此,非病毒基因传递是研发的热点。转子系统的基因整合具有一定的靶向性,成本低,发展潜力大,成为临床实践T细胞基因转导系统。转基因载体由一个人携带。CAR(转座)质粒由携带转座酶的质粒组成,通过电穿孔进入T转座酶表达后作用于细胞CAR侧翼末端导致重复序列,导致重复序列T细胞基因组TA二核苷酸序列切除整合,插入CAR转录表达后在细胞表面产生基因CAR。目前有基于Sleeping Beauty(SB,睡美人PiggyBac(PB)转座系统。
mRNA电穿孔是将CAR基因导入T细胞是最简单、最安全的方法,但是mRNA多次要求不稳定性T细胞输注。
表2 CAR比较基因转导方法
(4)细胞扩增培养
通过生物反应器等细胞培养设备T细胞扩张和培养。患者只能分离少量淋巴细胞,大多数患有白细胞减少症等并发症,需要适当的淋巴细胞T淋巴细胞扩张以达到治疗目的。许多病人最终无法接受。CAR-T治疗的原因在于这些病人T细胞不能在体外完全扩张,也不能达到目标剂量。CAR-T细胞扩增需要一个封闭、自动化和可控的扩增平台。细胞培养可以通过不同的容器进行扩增,包括T瓶子、平板或培养袋和生物反应器。使用摇摆式生物反应器(如摇摆式生物反应器)WAVE)扩增是目前主要的培养方式,此外,自动细胞培养生产设备(如细胞培养生产设备)CliniMACS Prodigy)也能产生很多CAR-T,与摇摆式生物反应器相比,这种自动化设备大大减少了人工操作。
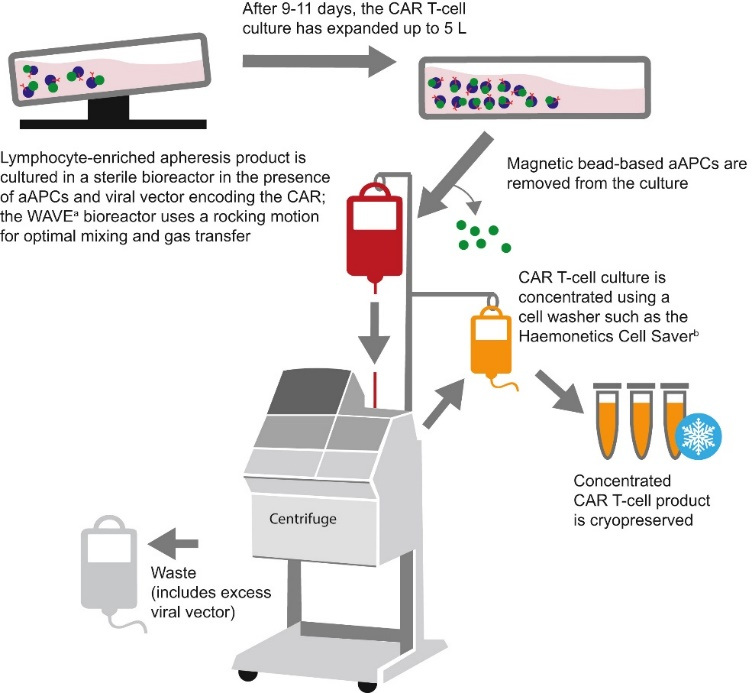
图4 T细胞培养过程
(5)冷冻运输,最终回输患者
根据配方调整细胞数量和培养基成分,然后将产品转移到合适的容器进行冷冻和运输,最后返回给患者。复制扩展T细胞通过静脉输液输入患者体内,有效增加血液中的杀伤性T确定肿瘤细胞的数量,以有效地杀死肿瘤细胞。联合静脉输注 局部注射CAR-T细胞治疗复发性弥漫性大B细胞淋巴瘤(DLBCL)结外病变,患者获得持久缓解,无严重不良反应,静脉输液 局部注射可能成为部分患者更好的回输方式。
02
CAR-T复杂的细胞制备工艺带来了高昂的成本
CAR-T影响细胞规模生产的因素
根据已披露的临床试验,CAR-T从白细胞收集到回输的疗法大多是在10-25大约每天,获取并激活T细胞1天,载体转染2天,扩大培养7天,制备和质量控制3天。Kymriah制备时间为22天,Yescarta17天。虽然目前细胞疗法开发过程中的基本方案相似,但工业界还没有开发出一个成熟、完全可接受的方案CAR-T生产工艺,很多CAR-T产品采用人工操作,耗时耗力,且难以扩大,失败率高。整个产品。CAR-T制备工艺非常复杂,相应的生产工艺优化相对较慢。
如前所述,相当大的可变因素可能会阻碍CAR-T细胞的制造,CAR-T细胞制造中变异的主要来源——
(A)操作变异(方法、人员、设备):这主要是操作员/操作设备变化的结果,特别是在使用手动处理系统时,完全自动化的制造程序可以尽量减少操作变异的影响;
(B)原料和试剂(血清、培养基、生长因子等)。:用于更好地实现细胞扩张的培养基和试剂(如细胞生长因子)尚未标准化,如果原料和试剂是基于GMP规范制造可能难以获得;
(C)环境变量(温度、粒子数、气体张力、湿度):CAR-T在细胞制造过程中,应监测环境参数,以确保制造过程的一致性、产品质量和无菌性。理论上,这些方面可以通过封闭的功能系统来实现;
(D)生物因素(起始材料的质量和组成):这是最重要的因素。生物因素是生物因素。CAR-T细胞制造中不可避免的变量 ,其中最重要的可变性包括:细胞活力、T细胞含量、健康状况和表型。
此外,不同患者的辅助细胞也会有很大的差异,如巨噬细胞和单核细胞。但细胞治疗产品质量控制的安全性、纯度、效率和均匀性将贯穿其中CAR-T生产的各个阶段也增加了CAR-T治疗费用。
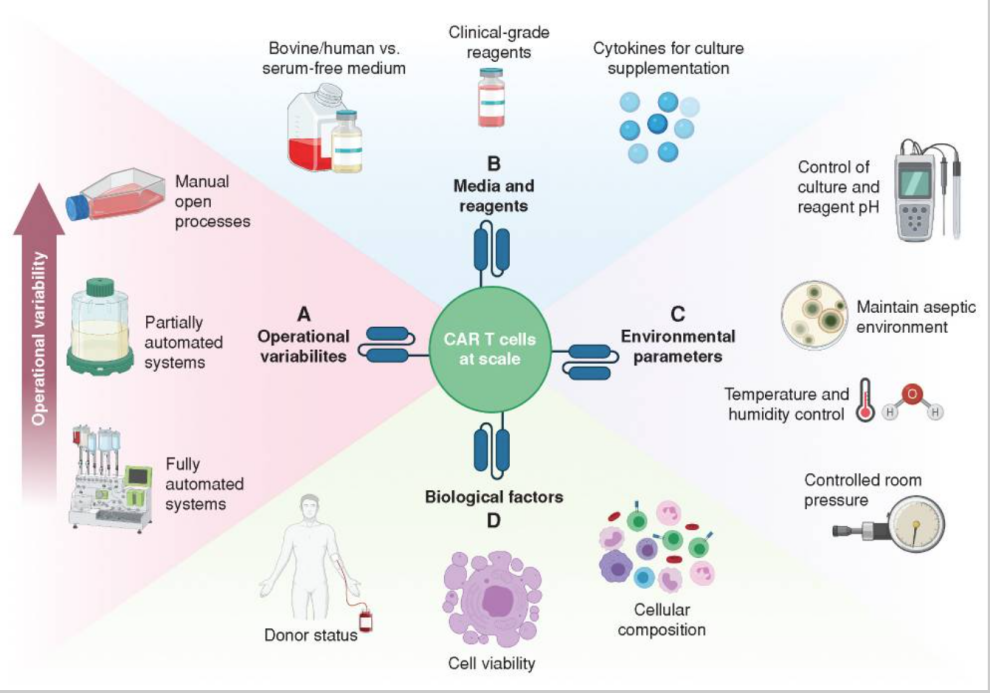
图5 CAR-T细胞规模生产中的变量
CAR-T细胞制备成本构成,耗材占总成本的一半
Kymriah在美国定价为47.5万美元/针,Yescarta在美国定价为37.3易凯达和倍诺达在中国上市的价格为120万元/针和129万元/针。CAR-T高价主要是由于患者个性化定制带来的高生产成本。
根据发表在《international journal of cancer》文献报告、生产单人份CAR-T细胞成本约为8万美元。CAR-T在整个生产过程中,培昂贵的成本是培高CAR-T培养液、质粒、核酶、病毒载体等耗材占用了成本49~51%,具体金额约5万美元/针。CAR-T生产和控制化学成分(CMC)水平相关,用于激活CD3/CD28beads例如,一管约8万元,准备一份CAR-T细胞需要使用1/1/14~1/3,若CMC如果要求则剩余beads不能再使用,这也会导致成本增加。使用病毒载体的病毒载体。GMP生产约占总成本的30%,当对病毒载体的需求增加时,可减少CAR-T以葛兰素史克慢病毒载体生产为例,细胞制备的生产成本为100剂CAR-T慢病毒载体时,成本约为2.51万美元/剂,生产1000剂时,成本约为4000美元/剂;生产1万剂时,成本约为1500美元/剂。二是质量控制过程测量CAR-T产品无菌水平、细胞存活、CAR表达水平等所需的耗材,占用总成本24~25%,具体金额约为2.5万美元/针。目前影响影响。CAR-T生产成本最大的两个因素是能力利用率和病毒载体。提高生产规模和降低基因转移载体的成本是降低CAR-T最有效的成本方式。
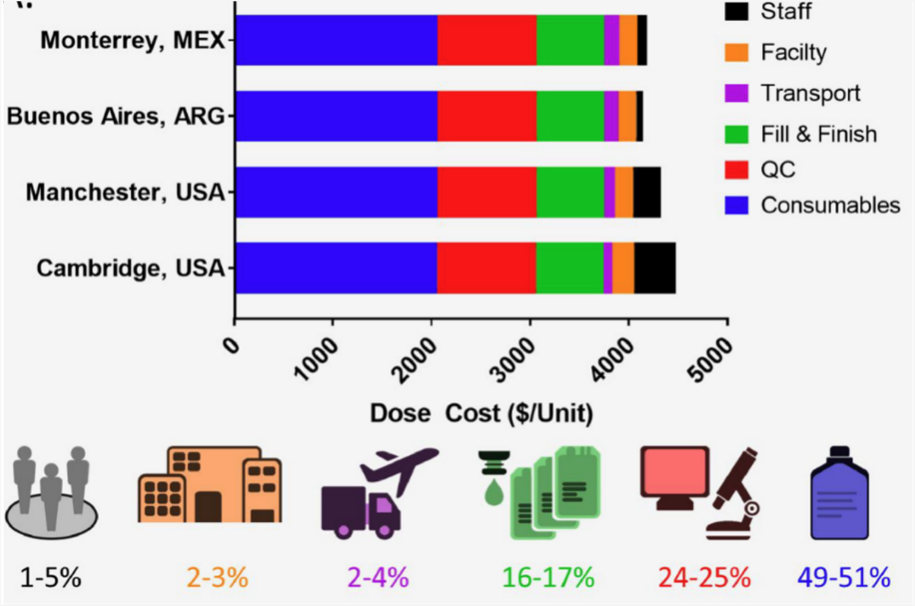
图6 CAR-T生产成本分析(Kymriah为例)
总之:CAR-T复杂的治疗过程和个性化个性化定制是成本高的主要原因,限制了产品临床试验的推广和可及性。CAR-T细胞疗法治疗在临床应用中只有十几年的时间,随着细胞疗法治疗的发展,CAR-T细胞结构的逐步改胞结构,开发同一异体CAR-T已成为该疗法的下一个发展方向。通用型。CAR-T(UCAR-T)可实现生产工艺的规模化和标准化,可将生产成本降低90%,也期待着CAR-T降低治疗成本惠及更多患者。
资料来源:
(1)Chimeric antigen receptor-T cell therapy manufacturing: modelling the effect of offshore production on aggregate cost of goods.
(2)Structural evolution and prospect of chimeric antigen receptor T cell (CAR-T cell).
(3)Scalable Manufacturing of CAR T Cells for Cancer Immunotherapy.
(4)工业证券
