药研人员必读:梳理小分子新药研发全过程
写作 :羽衣
小分子药物是指化学合成活性物质小分子,小分子药物与生物大分子药物有许多优点,如体积小,结构小,小分子药物一般容易穿透细胞膜,几乎可以达到身体的任何目标,可以容易被身体吸收,特别是口服制剂。
口服给药是最简单的自我用药方法,患者的接受率最高,可以为患者提供更大的剂量灵活性。然而,生物聚合物药物(肽、蛋白质等)很难制成口服制剂,大多数只能通过注射或其他非口服方式给药,因为如果这些药物通过口服给药会导致药物吸收不良,进入血液循环的药物浓度很低。
造成这种现象的主要原因有两个:
1、大分子药物易被消化道中的消化酶水解;
二、大分子药物渗透性差,难以通过肠壁吸收。
相比之下,小分子药物作为一种传统的药物形式,具有不可替代的优势。由于其研发技术相对成熟,受到各研发公司的青睐。下面小编将带您了解小分子药物及其研发流程,希望对您的日常工作有所帮助。
小分子药物研发过程示意图:
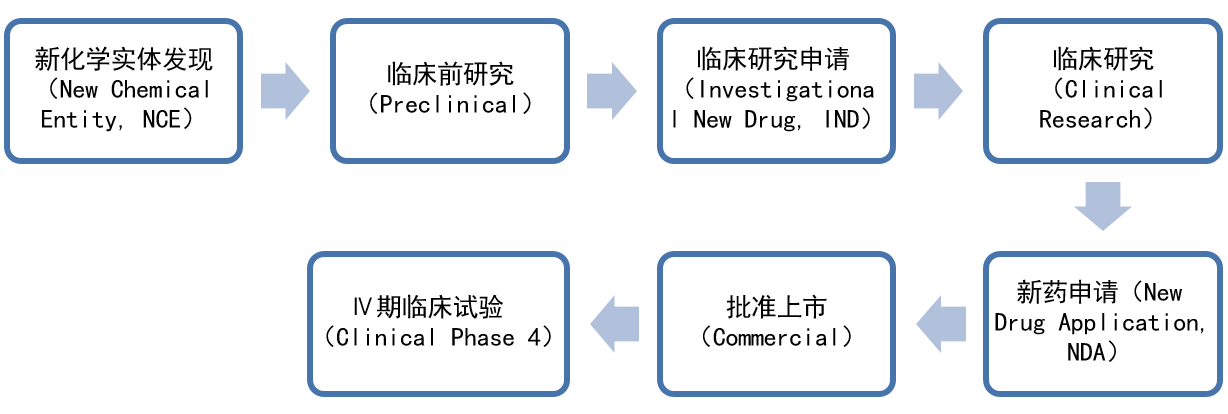
1
发现了新的化学实体
New Chemical Entity,NCE
当代新药化学实体发现的第一个任务是确定药物的目标,这实际上是所有工作的起点。只有当研究人员确定了药物的目标时,所有的后续工作才能有基础地进行。一般来说,一旦发现了药物作用的新目标,它往往成为一系列新药发现的突破。新的药物目标对药物研究和制药企业至关重要,甚至有一种说法是一个目标实现了一个行业。
发现药物靶点的主要途径有:
药物靶点从有效的单体化合物开始;
通过定量分析和比较,发现正常和疾病状态下蛋白质表达谱的变化;
通过正常组织与病理组织之间的基因表达差异来发现靶点;
药物靶点是基于蛋白质的相互作用;
应用RNA特殊的干扰技术抑制细胞中不同的基因表达,通过表型变化发现靶点;
当发现药物的作用靶点时,需要确认和验证其作用靶点。当药物的作用靶点得到验证和确认时,研究人员会根据靶点的空间结构设计一系列可匹配的分子结构,称为苗头化合物(Hit);
苗头化合物(Hit)先导化合物通过一系列的筛选和验证获得(Lead compounds):先导化合物是指具有一定活性或潜在活性的独特结构的化合物,一般具有新颖的化学结构,是现代新药研究的起点,可能由于活性小、选择性低、药代动力学性质差或毒性大,不能直接作为新药开发,但可在化合物结构的基础上进行一系列结构改造或装饰,得到符合治疗要求的新药。
先导化合物通常具有几个公认的特征:纯单一化合物、类药性和药理活性的可重复性、量效关系和活性通过特定机制、化学可操作性、化学装饰空间和类似物、合理的结构关系等。
先导化合物通过细胞活性、选择性筛选,进一步完成药代动力学和各种毒性测试和安全测试,基本达到临床前候选化合物的标准。
2
临床前研究
Preclinical
一般需要临床前研究2-4年,这一阶段有两个目的:
1、评价药物的药理学(药效学和药动学)和毒理学(急毒、生殖毒性、致癌、致畸、突变),研究药物的吸收、分布、代谢和排泄。这部分需要通过动物实验来研究,以确定药物的安全性和有效性。
2、生产工艺、质量控制和稳定性研究(本部分包括原料药合成工艺、原料药质量研究、原料药稳定性研究、制剂研究、辅料研究、制剂稳定性研究等)。有些内容需要GMP环境研究,有的不需要。
3
临床研究申请
Investigational New Drug,IND
化合物经临床前研究合格后,需向药监部门报告FDA提交新药临床研究申请(IND),这种化合物可用于人体试验。
新药临床研究申请需要提供以前的试验材料,以及计划将在哪里,以及如何解释临床试验、新化合物结构、给药方法、动物试验中发现的所有毒性以及化合物的制造和生产。
所有临床方案必须通过伦理审评委员会(InstitutionalReview Board,IRB)每年的考试和通过,也必须正确的FDA和IRB报告临床试验的过程和结果。在美国,如果在提交申请后30天内提交申请,FDA如果没有驳回申请,新药临床研究申请将被视为有效,可以进行人体试验。在中国,需要获得。NMPA正式批准,方可进入临床。
4
临床研究
Clinical Research
药物的临床研究一般需要3-7年,分为四个阶段:
Ⅰ期临床试验(Clinical Phase 1)
Ⅱ期临床试验(Clinical Phase 2)
Ⅲ期临床试验(Clinical Phase 3)
Ⅳ期临床试验(Clinical Phase 4)
其中Ⅰ期临床试验(Clinical Phase 1)是药物首次应用于人体的研究,其主要目的是安全研究,受试者为正常人,一般为正常人,一般为20-100例;
Ⅱ期临床试验的主要目的是进行有效性研究,给药对象为患者,一般是100-500例;
Ⅲ期临床试验的主要目的是确认二期临床研究的结果。本阶段的研究将增加受试者的数量,一般为1000-5000例;
Ⅳ期临床试验是在药物上市后的实际应用过程中加强检测,在更广泛、更长期的实际应用中继续检查疗效和不良反应。
Ⅰ-Ⅲ临床研究在整个药物研发过程中非常重要,下面小编简要介绍一下这一部分。
我们所知道的临床实践Ⅰ-Ⅲ期研究是临床实验阶段的传统划分,但随着药物研究的发展,研发人员对临床研究有了新的划分,如Ⅱ期又分为Ⅱa和Ⅱb,这是因为有时一个设计无法完成所需的探索,设计成两个探索,从而分为两个探索Ⅱa和Ⅱb。比如Ⅱa探索不同的给药剂量,Ⅱb探索不同的疗程。
后来,一些研发工作者提出了0期研究的概念。后来又提出了0/Ⅰ早期临床研究,Ⅱa中期临床研究,Ⅱb和Ⅲ期为晚期临床研究,临床研究的分期很大程度上是基于肿瘤药物的研发。
所以在这里我们必须清楚,分期付款的一端是研发目的,另一端是相应的设计框架。事实上,无论如何分期付款,其目的都是了解每个阶段的研发任务,实现相应的研发目的,从而顺利推进药物研发过程。
5
新药申请
New Drug Application,NDA
新药申请的第一步是准备申请材料,由五个模块组成:
1. 行政法规信息;
2. 概述:药物质量、非临床、临床试验的高度概述;
3.详细介绍药品质量;
4. 非临床研究报告;
5. 临床研究报告。
准备好申报材料后,正式提出申报材料NDA是的。新药申请需要经过一系列的过程,过程的繁琐程度远远大于新药临床研究申请(Investigational New Drug,IND)。
这里有几个特殊的申请程序,我们都需要了解。了解后,我们将评估我们研究的新药是否属于以下项目。如果是这样,我们会提前祝贺你。我们有评估优先权~
优先审评(Priority Reviews)
适用于治疗、诊断或预防疾病明显改善的药物,优先考虑NDA审评。
加速审评(Accelerated Approval)
用于治疗严重或危及生命疾病的药物,有合理可测量的替代重点" ,即药物预期治疗效果指标,灵活评价标准,采用替代终点评价。
快速通道(Fast-track)
用于治疗严重或危及生命疾病的药物,有潜力满足临床未满足的医疗需求,早期干预,密切沟通,分阶段提交申请材料。
6
批准上市
Commercial
药物研发的初衷是治疗疾病,让患者摆脱痛苦的纠缠。当一种药物经历了各种困难和风险,最终获得批准并上市时,这种药物可以被大多数人接触到。一种药物是否好不是研发人员的最终决定权,而是病人的最终决定权。
所以你真的认为药物批准上市了,即使研发成功了吗?事实上,新药批准上市并不是研究的结束,而是另一项研究的开始。
7
Ⅳ期临床试验
Clinical Phase 4
正如我们上面所说,新药上市后的研究属于临床Ⅳ本阶段需要继续监测其疗效和不良反应,药品监督管理部门要求根据本阶段的监测结果修改药品使用说明书。
在这个阶段,我们还需要研究药物的配伍使用和禁忌。如果现阶段批准上市的药物发现严重不良反应,也可能面临被下架的风险。在此期间,新药持有企业还必须定期向药品监督管理部门提交相关信息,包括药品的副作用和质量管理记录。药品一般上市后4-10年度需要再审批,其目的是审核NDA有效性和安全性。
