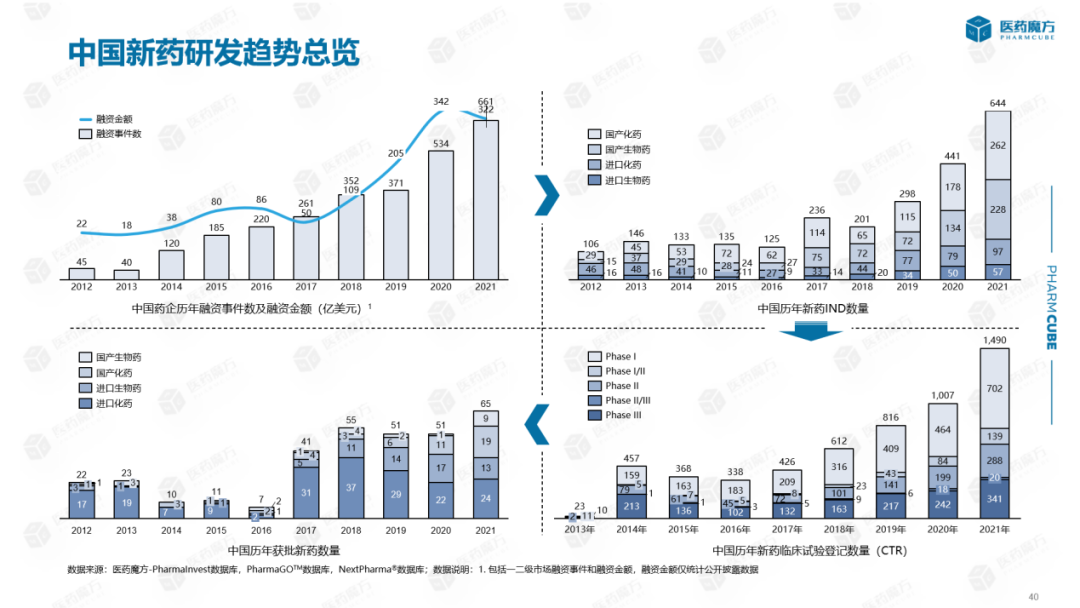
近十年来,中国创新药NDA以及对上市药品的全景解读
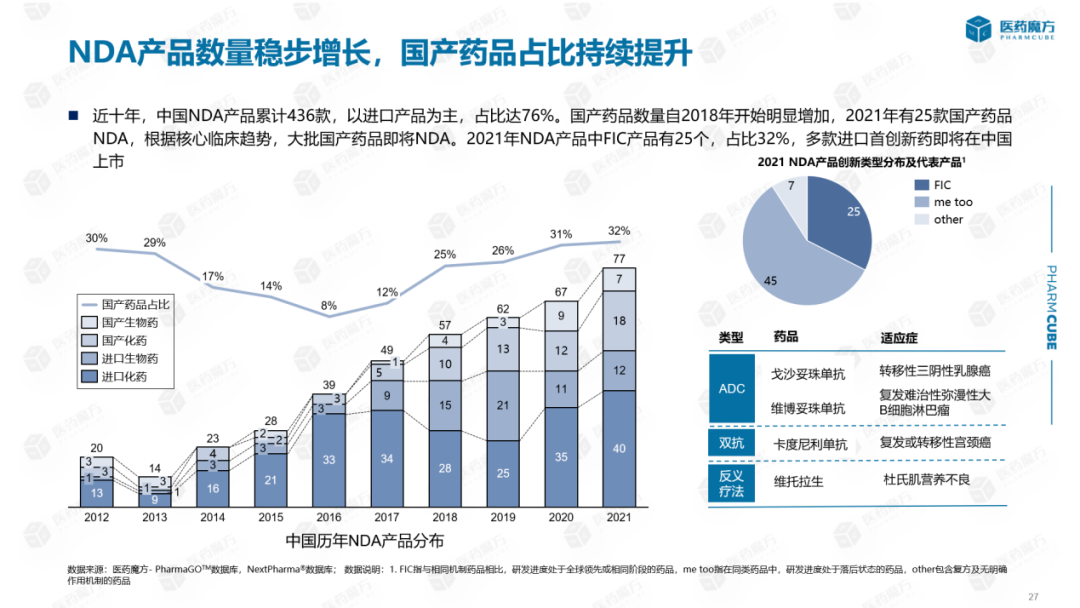
从国内申请上市的新药来看:近十年来,中国在中国申请上市NDA共有436种产品,主要是进口产品,占76%。自2016年以来,国产药品数量大幅增加,从 8%增加到2021年的32%。根据核心临床趋势,未来几年仍将有大量国产药品NDA。从创新的角度看,2021年NDA产品中有25种产品FIC,约占1/3,其中大部分是进口产品。
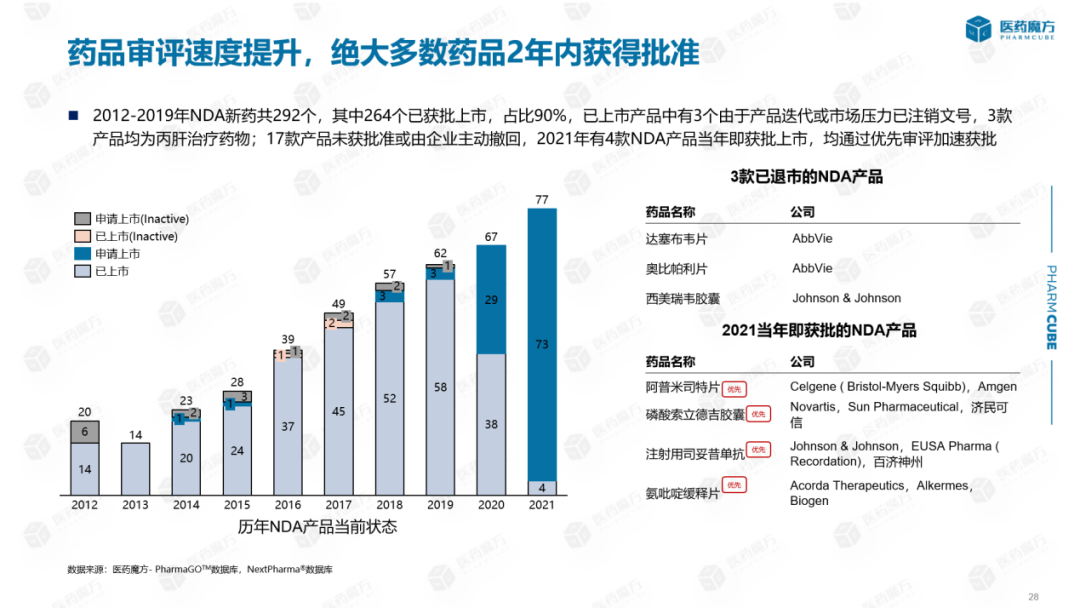
从历年申报上市产品的现状来看:2012年-2019年NDA共有292种新药,其中264种已获批上市,占90%。3种已上市产品因产品迭代或市场压力被注销。3种产品均为丙型肝炎治疗药物,17种产品未经批准或企业主动撤销。2021年有4种NDA产品当年获批上市,均通过优先审查加快获批。此外,还有两款值得关注的产品,2014年和2015年提交NDA申请,但经过6次~七年还在NDA这两种产品分别是天津红日健达康的甲苯磺酰胺注射液和恒瑞的磷酸瑞格列汀片。
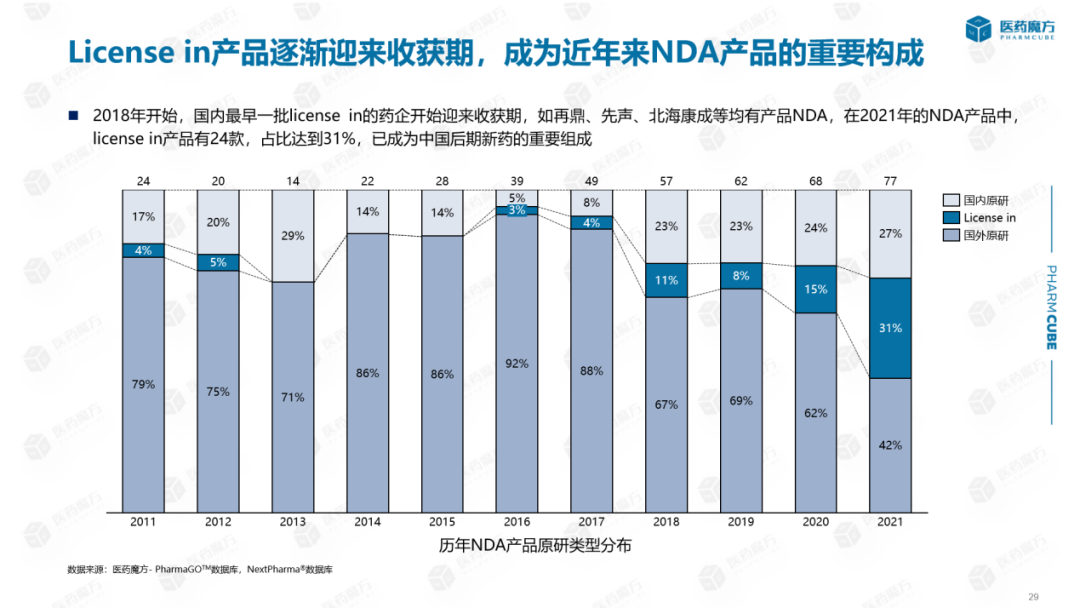
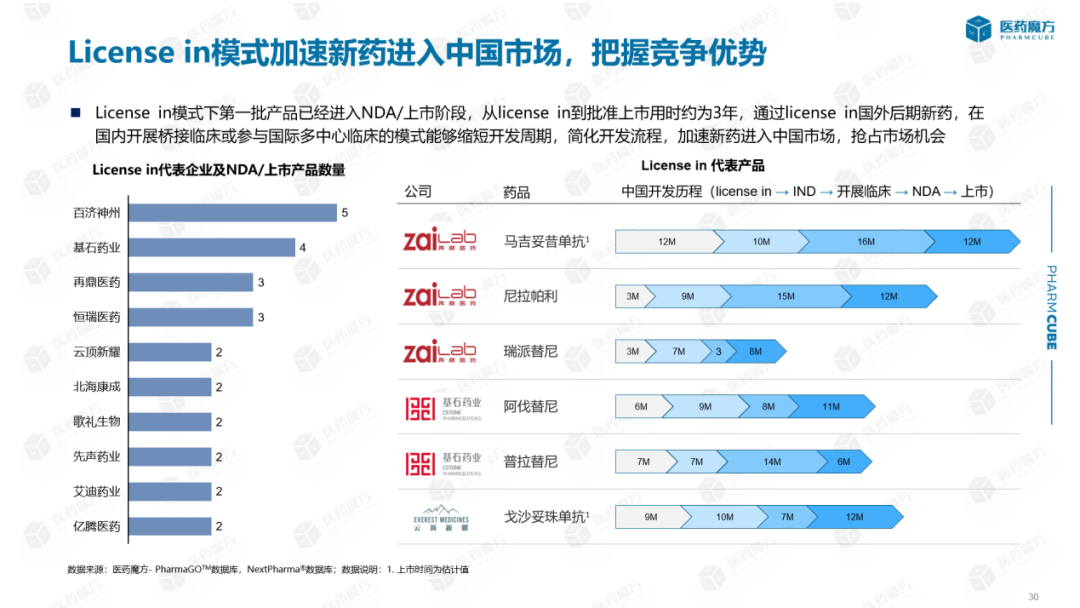
从历年NDA中原研究与产品License-in根据产品比例分析:自2016年以来,纯国外原研产品比例逐渐下降。相反,自2016年以来,一些产品的比例一直在下降。license in产品开始申报上市,license in近年来,产品比例逐渐增加。创新药企通过交易快速整合外部资源,形成互补优势。中国最早的一批license in药企开始迎来收获期,如再鼎、先声、北海康成等产品NDA。在2021年的NDA产品中,license in产品有24种,占31%,已成为我国后期新药的重要组成部分。
License in该模式可以加速新药进入中国市场,增强企业的竞争优势,使患者能够尽快接触到这些急需的先进临床治疗方案。例如,尼拉帕利在引进后3个月内在中国申请临床实践。批准后9个月开始临床实践,15个月完成相关临床试验,申请上市,最后12个月批准。License in第一批产品已进入模式NDA/上市阶段,数据显示:从上市阶段开始,license in批准上市大约需要3年时间。license in在国外后期开展桥接临床或参与国际多中心临床可以缩短开发周期,简化开发过程,加快新药进入中国市场,抓住市场机遇。
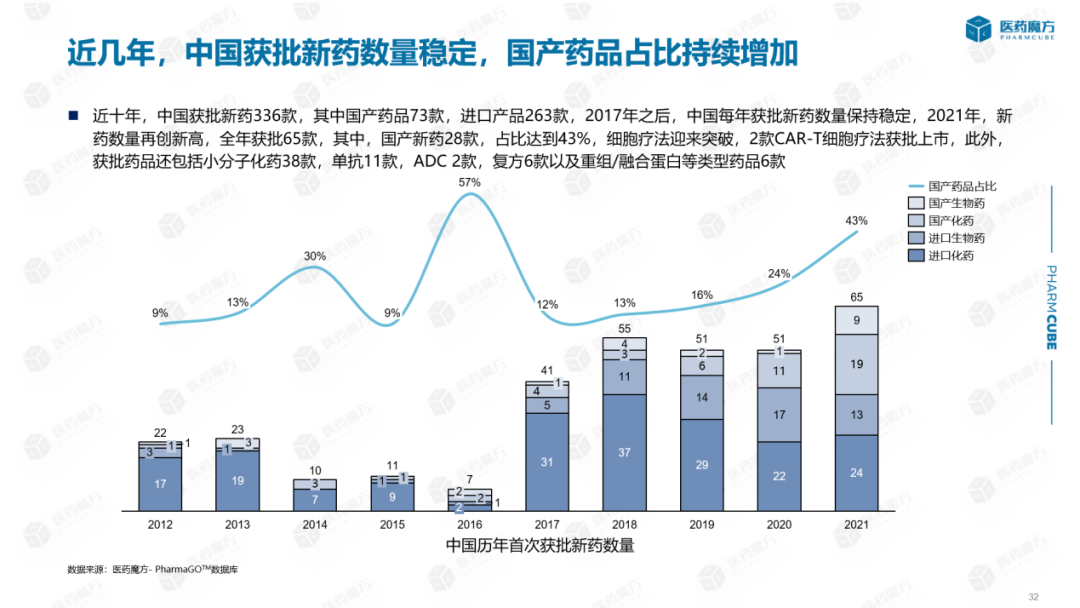
从近十年上市药品情况看:中国获批新药336种,其中国产药73种,进口产品263种。2017年以后,中国每年获批的新药数量保持稳定。2021年,新药数量再创新高,全年获批65种。2017年以后,国产药品的比例也在逐步提高。2021年,中国获批药品28种,占43%。药品审查改革取得初步成效。细胞疗法迎来突破,2种CAR-T细胞疗法获批上市。此外,获批药品还包括38种小分子化药,11种单抗,ADC 2、6种复方药和6种重组/融合蛋白药。
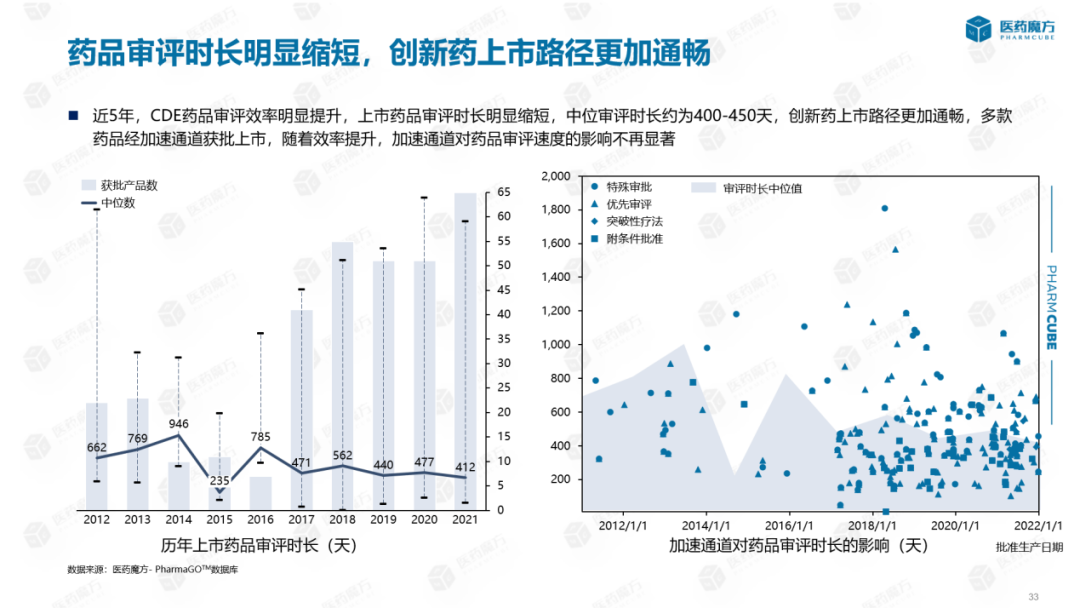
从CDE从审批效率和审批时间来看:近5年,CDE药品评价效率显著提高,上市药品评价时间显著缩短,从600天缩短到400多天,使创新药品上市路径更加顺畅。此外,许多药品已经通过加速渠道获得批准,但随着效率的提高,加速渠道对药品评价速度的影响不再显著。
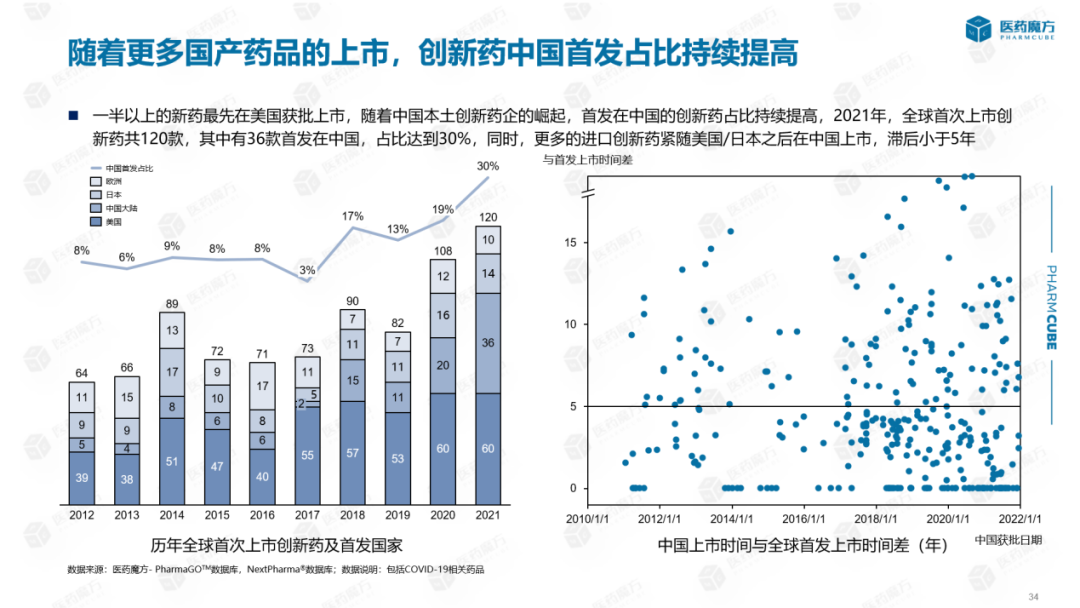
从历年全球首次上市的创新药首发国家来看,由于美国医药市场占全球比最大,超过一半的新药首次获批在美国上市。然而,随着中国本土创新药企的崛起,我国首次上市的创新药比重不断提高。2021年,全球首次上市创新药120种,其中36种首次在中国上市,占30%。与此同时,更多的进口创新药在美国/日本之后在中国上市。
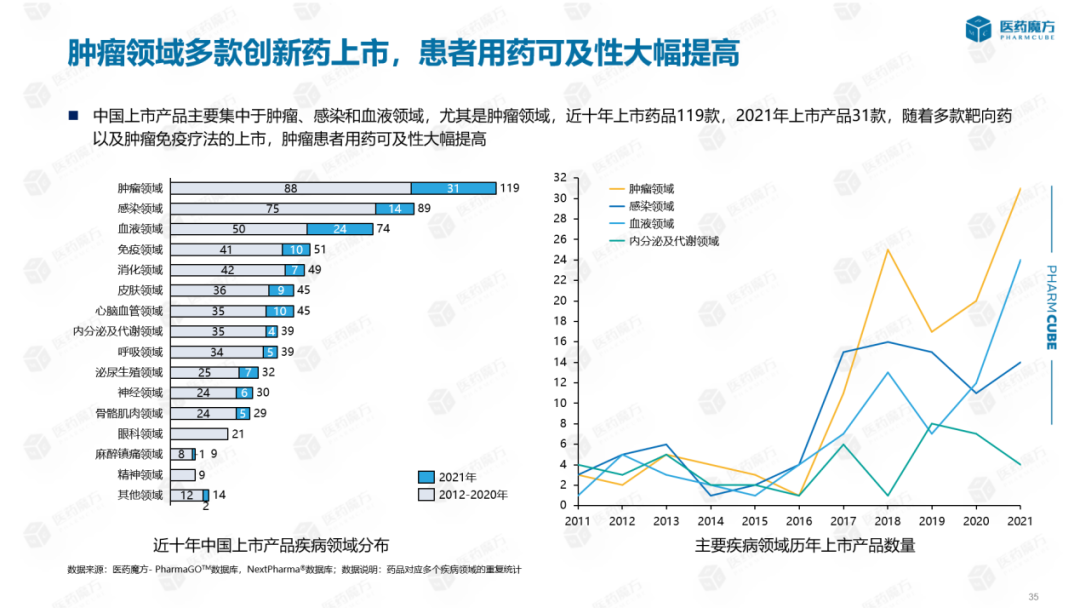
从我国上市产品疾病领域的分布来看:我国上市产品主要集中在肿瘤、感染和血液领域,特别是肿瘤领域,近十年上市药品119种,2021年上市产品31种。根据年度趋势统计,自2017年以来,肿瘤领域的大量产品开始上市,包括针对肿瘤的靶向药物和免疫疗法,这些产品的上市也大大提高了国内肿瘤患者的可及性。
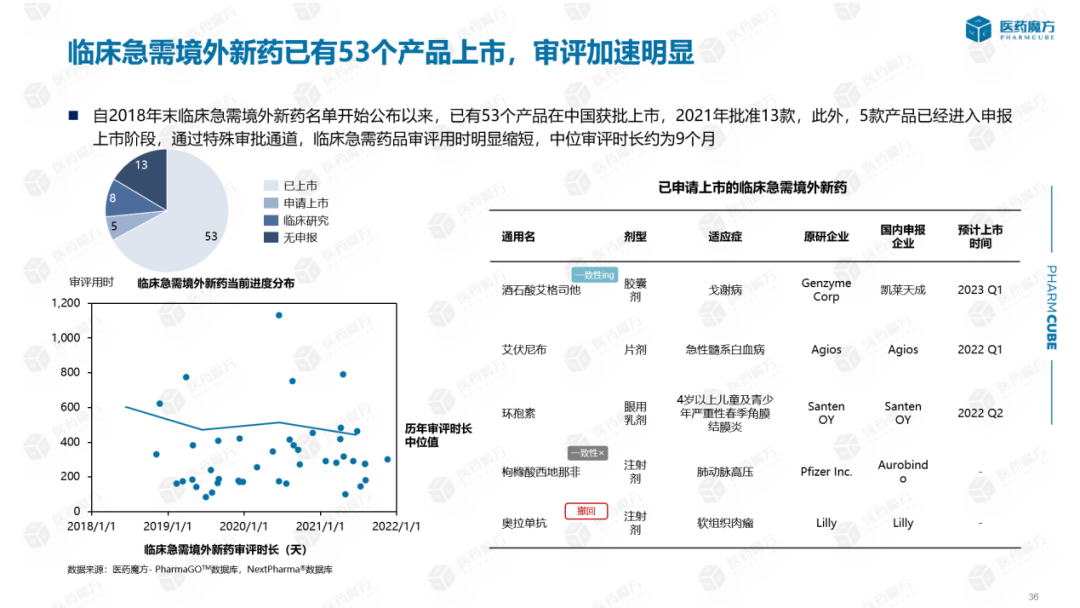
从临床急需海外新药评价情况来看:自2018年底临床急需海外新药名单公布以来,中国已批准上市53种产品,2021年已批准13种产品。此外,5种产品已进入申请上市阶段。因为列入临床急需清单的产品符合一定条件,可以避免临床申请上市,并采取特殊的审批渠道,临床急需药品评价的时间明显缩短。数据显示,临床急需产品的评价时间一般低于历年评价时间的中值,中值评价时间约为9个月。
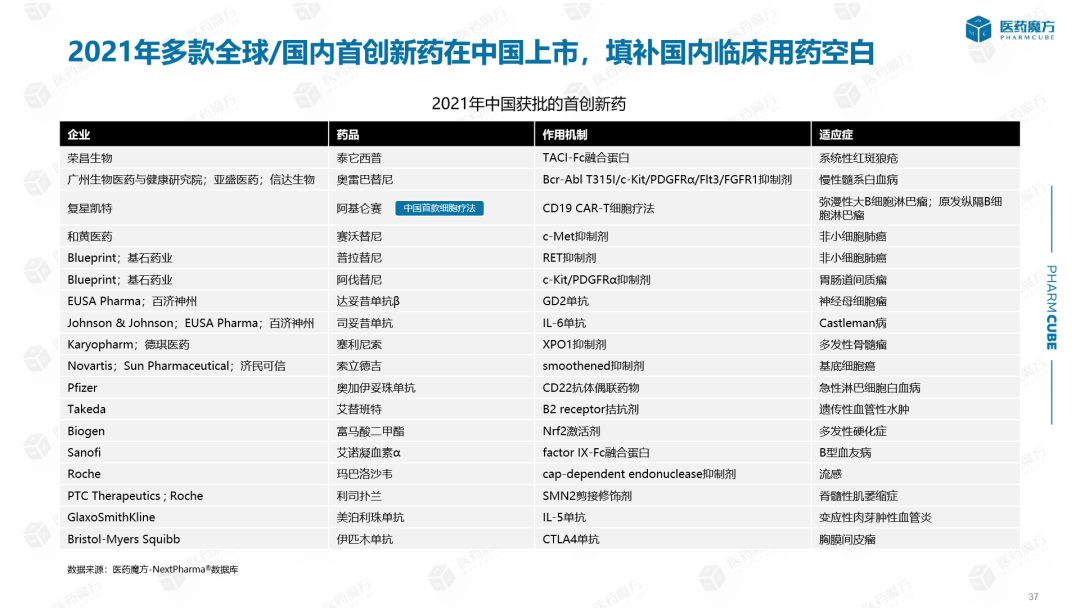
2021年,全球首款或国内首款新药在中国上市:如荣昌生物泰其西普,是全球首款TACR-Fc融合蛋白用于治疗系统性红斑狼疮,也是继贝利尤单抗之后中国第二种用于系统性红斑狼疮的生物制剂。亚盛医药的奥雷巴替尼是中国第一个用于它的Bcr-Abl315突变抑制剂也是亚盛医药上市的第一款产品。复兴凯特的阿基伦塞是中国第一种获批上市的细胞疗法,黄塞沃替尼是中国第一种c-Met抑制剂。此外,基石药业和百济神州还分别上市了两大产品,填补了国内临床用药的空白。
近十年来,创新药在中国上市top从15家中外制药公司来看:诺华产品数量最多,在中国成功上市35种产品;在国内制药公司中,恒瑞在2021年结束时获得了10种上市创新药品。对于这些已经进入商业化阶段的传统制药公司,下一步是提高创新药物收入在整体收入中的比例,顺利进入商业化,使企业有更充足的资金投资新药研发,实现创新药物开发的闭环。

最后,总结中国创新药物发展趋势:
首先,从时间上看,2014年,资本开始大量注入医药行业,融资事件越来越多。2017年,国内IND新药的数量和相应的临床试验继续增加。2021年,大量国产新药开始获批上市。从这一趋势来看,国内医药行业正在发生巨大变化,未来将保持快速增长。也存在一些问题。比如目前国内正在研究的产品还是以me too主要原因是,这将导致当前临床开发资源与未来产品上市和销售之间的竞争。鉴于此,制药行业的基本逻辑是临床需求与药品研发供应之间的关系。创新和国际化的临床需求是中国制药公司应该坚持的方向,公司应该坚持的方向。
第二,虽然与往年相比,审评效率有了很大提高,但随着审评效率的显著提高,IND新药和2016年新药的增长-2020年第一波核心临床结束带来的第一波核心临床结束NDA随着适应症申请的增加,药品评审机构未来仍将面临巨大压力。
第三,从创新能力的角度来看,我国产品研发仍以跟随创新为主。面对日益激烈的竞争,创新药物靶点的发展正在向前推进,风险也在增加。发现早期新药开发机会的能力更为重要。新兴制药企业的黄金时代即将过去,将面临临床试验和商业化的考验。一些企业将商业化过程转移给大型制药企业。在这样的环境下,制药行业迎来了整合,创新技术的新兴企业可能被收购,具有全球新药开发竞争力的中国顶级制药企业将逐步出现。