胆管癌 信达生物小分子抗肿瘤药物Pemigatinib预计近期将获批
3月22日获悉,信达生物成纤维细胞生长因子受体(FGFR)1/2/3抑制剂pemigatinib影片上市申请已离开第一轮补充资料队列,离获批上市又近了一步。若获批,pemigatinib将成为中国第一款FGFR抑制剂。
Pemigatinib由Incyte公司于2020年4月在美国获批上市,商品名称为Pemazyre?。
2018年12月和2018年12月,信达生物Incyte达成战略合作,获得包括公司在内的公司Pemigatinib中国大陆、香港、澳门、台湾的临床开发和商业权益,包括三种药物,Incyte公司获得信达生物4000万美元首付款,首次提交IND第二笔2000万美元支付、潜在开发和监管里程碑款最高1.29亿美元和潜在商业里程碑2.0251亿美元。合作中的另外两款分别为itacitinib(JAK1抑制剂)和parsaclisib(PI3Kδ抑制剂)。
2021年6月21日,pemigatinib在台湾市场获批(中文通用名:培美替尼;商品名称:达伯坦),成为信达生物批准的第一款小分子药品;2022年1月24日,pemigatinib又在香港获批。
据Insight在数据库中,培美替尼于2021年7月在中国大陆申报上市,随后被上市,随后被上市。CDE列入优先考核名单,用于过去至少接受过一种系统治疗,经检测确认存在FGFR2晚期、转移性或不可手术切除的胆管癌成人患者。
「培美替尼」项目国内研发进度概览
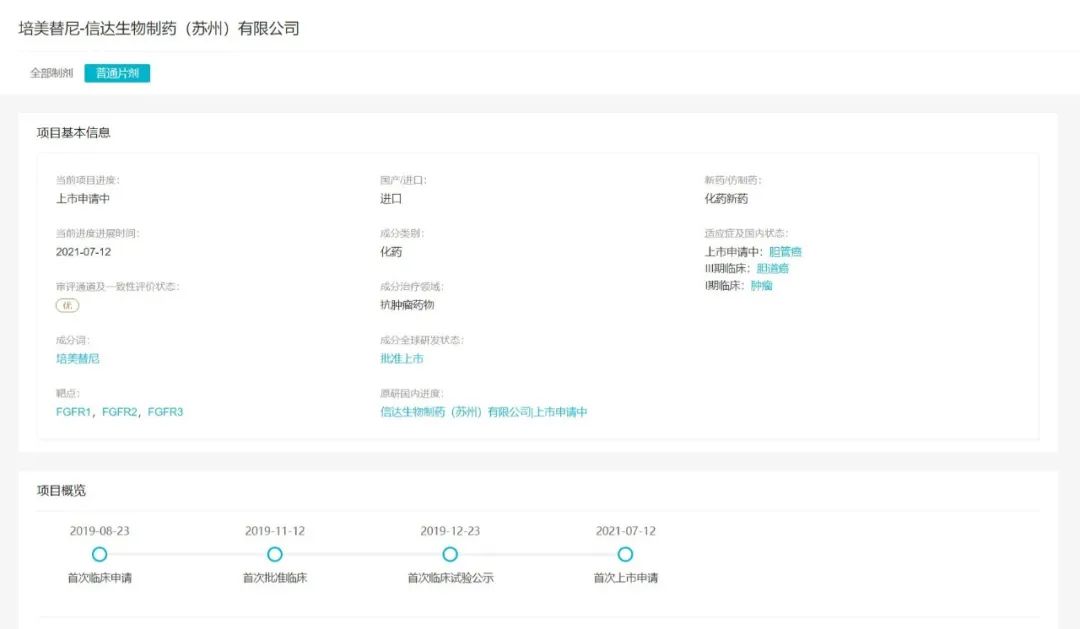
来自:Insight数据库项目进度模块(http://db.dxy.cn/v5/home/)
培美替尼在中国的上市申请是建立在过去至少经过一线系统治疗失败的基础上的FGFR2局部晚期、复发性或转移性胆管癌受试者对整合或重排、手术不可切除的进行评估pemigatinib疗效与安全II期、开放、单臂、多中心研究。这项研究也被称为研究。CIBI375A201(NCT04256980),在国外进行FIGHT-202研究(INCB54828-202,NCT02924376)桥接试验。主要终点为独立影像委员会。(IRRC)根据实体瘤评价标准V1.1客观缓解评价(ORR)。
在FIGHT-202在研究过程中,共有108名胆管癌受试者入组接受,pemigatinib13.5mg基于口服治疗IRRC已确认的评估ORR为37%(95%CI:27.94%,46.86%),包括4例完全缓解(3.7%)和36例部分缓解(33.3%)中位缓解持续时间(DOR)为8.08个月(95%CI:5.65,13.14),中位无进展生存期(PFS)为7.03个月(95%CI:6.08,10.48),pemigatinib可引起肿瘤持久缓解,中位总生存期(OS)达17.48个月(95%CI:14.42,22.93)。
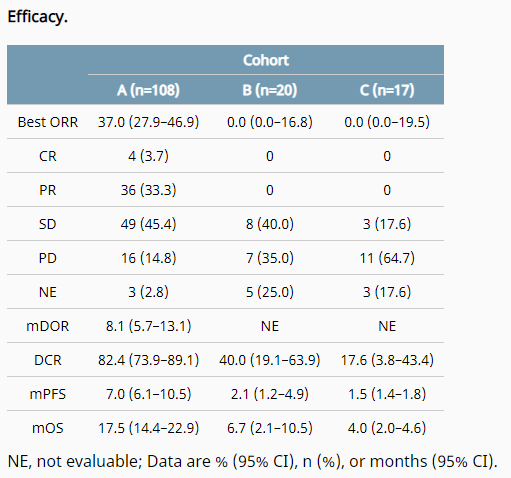
DOI:10.1200/JCO.2021.39.15_suppl.4086
JournalofClinicalOncology39,no.15_suppl(May20,2021)4086-4086.
安全方面,pemigatinib耐受性好。在147例纳入安全分析的受试者中,高磷酸血症是最常见的不良反应,发病率为58.5%。有68.7%的受试者有3级或3级以上的不良反应,最常报告的是低磷酸血症(14.3%)6.1%)、腹痛、疲劳、低钠血症(均为5.4%),其他有掌跖红肿综合征和低血压,发病率分别为4.8%和4.1%。
国内桥接试验INCB54828-202研究数据已经存在2021ESMO以壁报的形式发布。试验分为两部分,第一部分是在中国人群中。PK第二部分包括31例胆管癌受试者;FGFR2基因融合或重排阳性胆管癌受试者的临床主要终点是第二部分受试者。IRRC依据RECISTv1.1评估的ORR。
在30例疗效可评人群中,15例患者达到IRRC确认的疾病缓解,主要终点指标ORR达到50%(95%CI:31.3%,68.7%)。中位随访5.1312例患者仍处于病情缓解状态,中位缓解持续时间(DOR)未达到(95%)CI:3.4,NR),到数据截止日期,中位无进展生存期(PFS)数据还不成熟,只有6例发生PFS事件,疾病控制率(DCR)为100%(95%CI:88.4%,100%)。
胆道癌(BTC)它是一种罕见的侵袭性癌症,发生在胆管和胆囊中。胆管癌起源于胆管上皮细胞,是肝脏第二常见的恶性肿瘤。乙肝病毒和其他肝寄生虫感染导致亚洲发病率高。
胆管癌适应症水平(Insight)
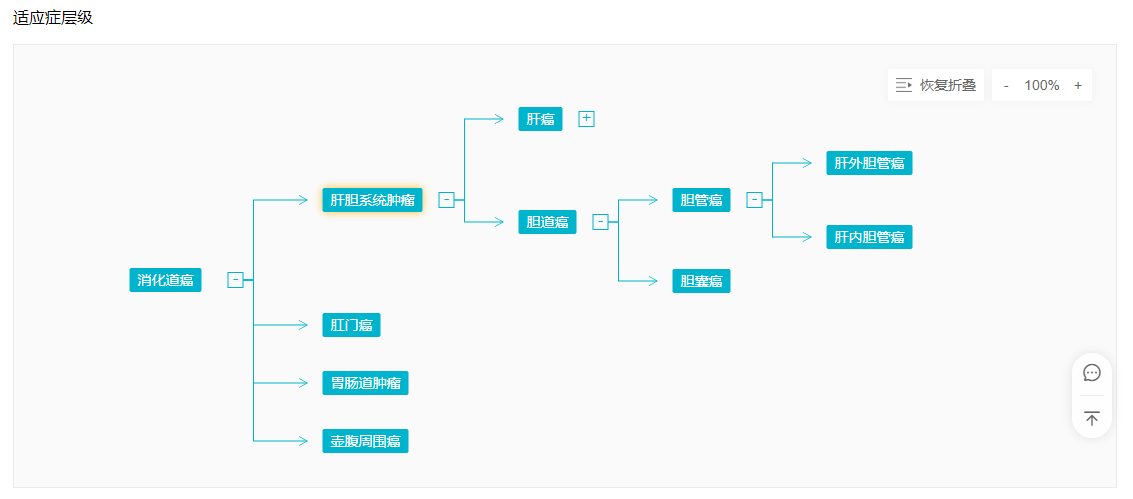
来自:Insight数据库适应症模块(http://db.dxy.cn/v5/home/)
手术是目前唯一具有治愈潜力的治疗方法,但大多数胆管癌患者在初步诊断中是不可切除性肿瘤或转移,失去了根治手术的机会。这类患者的一线标准治疗是顺铂和吉西他滨,但中等总生存期(OS)约11.7治疗效果有限;一线治疗失败后,患者建议积极控制症状 mFOLFOX治疗方案,中位OS仅为5-6一个月内,急需能提高患者生活质量和疗效的药物。
从靶向药物的角度看,FDA目前只批准了三种胆管癌靶向药物。这三种胆管癌治疗药物在2020年和2021年刚刚获批,其中两种是FGFR抑制剂,信达/Incyte的Pemigatinib和联拓/BrigeBio的Infigratinib;一款为IDH1艾伏尼布是抑制剂AgiosPharmaceuticals开发、基石药业引进。
从免疫疗法的角度来看,这种癌种也是不断的挫折,2021年默克的PD-L1/TGFβ双特异性融合蛋白M7824正是在胆道癌方面,一线二线二连败。第一个积极突破的是阿斯利康。PD-L1度伐利特单抗(Imfinzi),预计今年新适应症申报后,胆道癌领域免疫疗法将破零。
