一文读懂 | 抗体、载荷、连接器:9款已上市ADC结构艺术
文章来源:医药魔方Med
作者:阿拉蕾
抗体偶联药物(antibody-drug conjugate,ADC)是肿瘤领域药物研发的热点。一切都是。ADC它们都含有三种核心成分:与肿瘤相关的抗原结合的抗体(antibody),细胞毒性负荷(payload),连接子(linker)。每一个核心成分都可以与肿瘤和肿瘤微环境相结合(TME)复杂的相互作用。
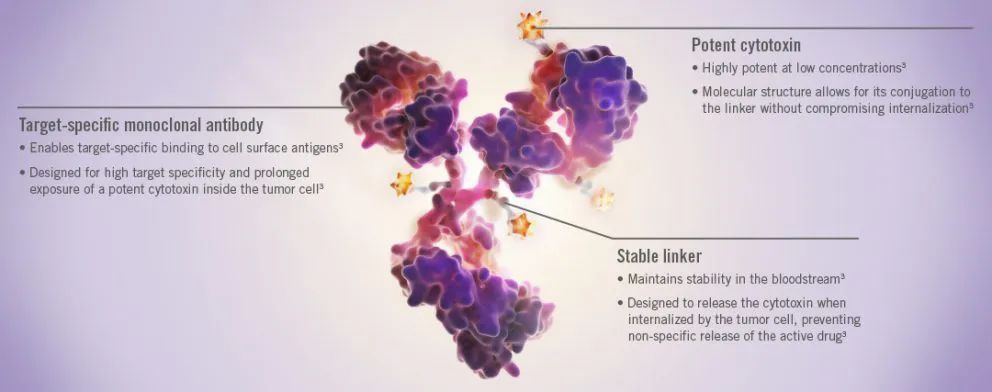
图片来自:genetech oncology官网
不同的ADC,这三种核心成分可能会有很大的差异,从而影响它们的药理特性、有效性和安全性。深入了解。ADC,从了解它们的结构开始。本文以此为基础。Nat Rev Clin Oncol2021年6月发表的一篇文献于2021年6月发表 [1],9款已上市ADC切入,带大家一探究竟。
ADC发展的简史
ADC概念的提出可以追溯到20世纪初,科学家Paul Ehrlich构想出一种能释放细胞毒性药物的魔法子弹。ADC肿瘤临床试验始于20世纪80年代,没有显示生存效益,但观察到明显的毒性,这种情况持续下去~20年,直至CD33靶向药物gemtuzumab ozogamicin(2000年,第一个适应症是复发或难治性急性髓细胞白血病)FDA批准的第1个ADC。但由于不良反应,2010年退市。
2011年,CD30维布妥昔单抗(brentuximab vedotin)经典霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤获批(ALCL)治疗。不久之后,2013年,HER2恩美曲妥珠单抗靶向药物(adotrastuzumab emtansine,T-DM1)从此,上市。ADC研发步伐逐步加快。下表对已上市的9款车型进行了上市。ADC总结一下。
这9款ADC分别是:gemtuzumab ozogamicin,维布妥昔单抗,T-DM1,inotuzumab ozogamicin,T-DXd(DS-8201),polatuzumab vedotin,戈沙妥珠单抗,enfortumab vedotin,belantamab mmafodotin。
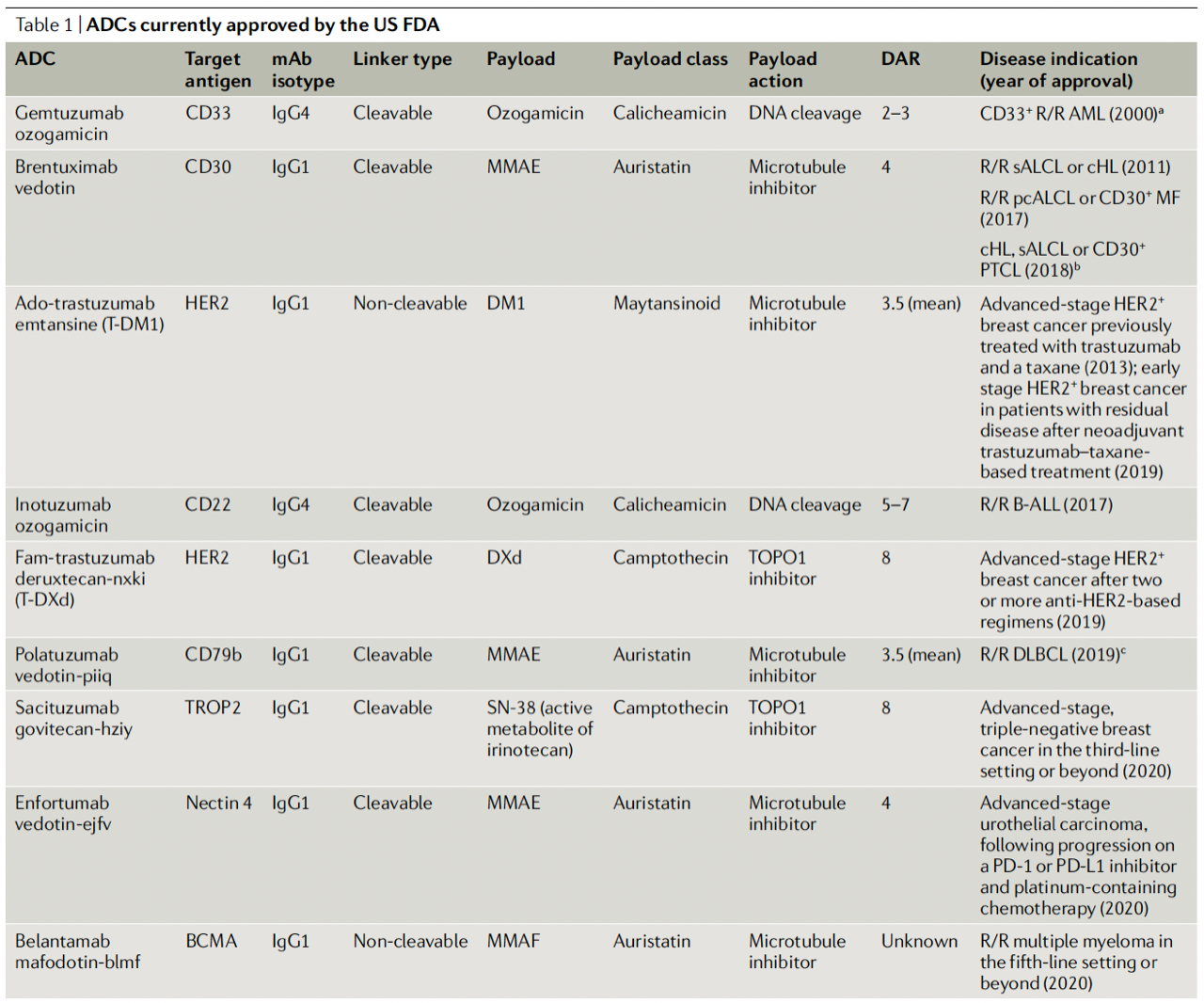
图片来自:Nat Rev Clin Oncol. 2021;327-344.
抗体(antibody)和靶点选择
免疫球蛋白G(IgG)是ADC主要的抗体骨架。IgG包括四类:IgG1、IgG2、IgG3 和IgG4,它们的恒定结构和铰链区域是不同的。这些差异会影响单克隆抗体(mAb)溶解度和半衰期,以及免疫效应细胞不同表达Fcγ受体(FcγR)的亲和力。
目前,大部分ADC使用IgG1为抗体骨架,少数使用IgG2或IgG4(例如:gemtuzumab ozogamicin和inotuzumab ozogamicin,两者都用过IgG4)。与IgG2和IgG4相比,IgG1血浆半衰期相似,但补体结合较高,补体结合较高FcγR结合率。IgG3它可能是最免疫的亚类,但由于其循环半衰期短,所以在ADC在设计中,通常避免使用这种抗体。
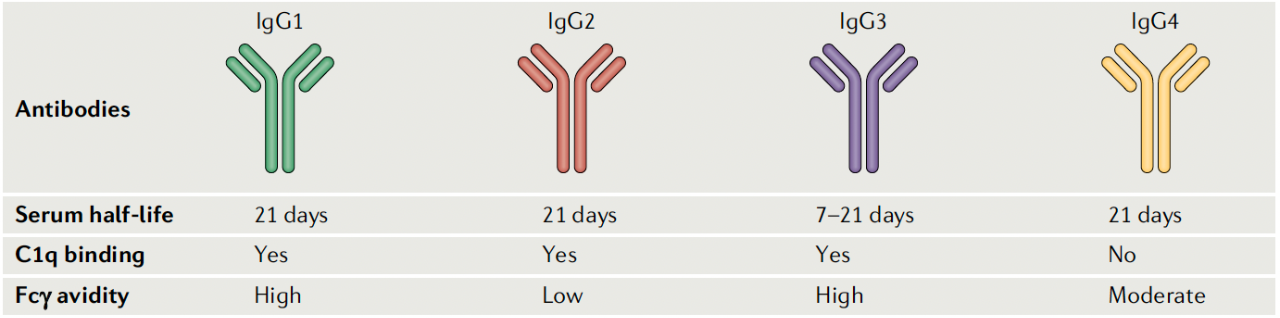
图片来自:Nat Rev Clin Oncol. 2021;327-344.
一个理想的mAb靶点应高度表达在肿瘤细胞上,而不是在正常细胞上。ADC它可以将细胞毒性物质的负荷输送到任何表达靶抗原的细胞。因此,与正常细胞相比,肿瘤细胞中表达的靶点可以提供一个更宽的治疗窗口,并降低全身毒性的机会。
目前已批准实体瘤治疗ADC靶点包括:HER2,TROP2,nectin-4。在血液系统肿瘤中,CD30维布妥昔单抗的目标是霍奇金淋巴瘤和维布妥昔单抗ALCL恶性淋巴细胞表达,并是其特征。CD22、CD79b、B细胞成熟抗原(BCMA)均具有B细胞谱系高度特异性。
除肿瘤特异性外,还有其他影响因素ADC疗效。例如,和HER2与同质性表达的患者相比,肿瘤内或肿瘤间HER2病人的异质表达T-DM1反应水平较差。此外,靶点周转率、内化率、溶酶体降解率等都会影响ADC抗肿瘤活性。
连接子(linker)类型和工艺
随着时间的推移,连接子技术取得了很大的进步。连接子主要有两个功能:一是确保药物在血浆中循环时细胞毒性的负荷(payload)它仍然牢牢地附着在抗体部位。如果连接器不稳定,可能会过早释放血浆中的负荷,不仅会增加全身不良反应的严重程度,还会减少肿瘤部位负荷的有效传递。其次,通常通过竞争作用,负荷可以在肿瘤(特别是肿瘤细胞)中有效释放。
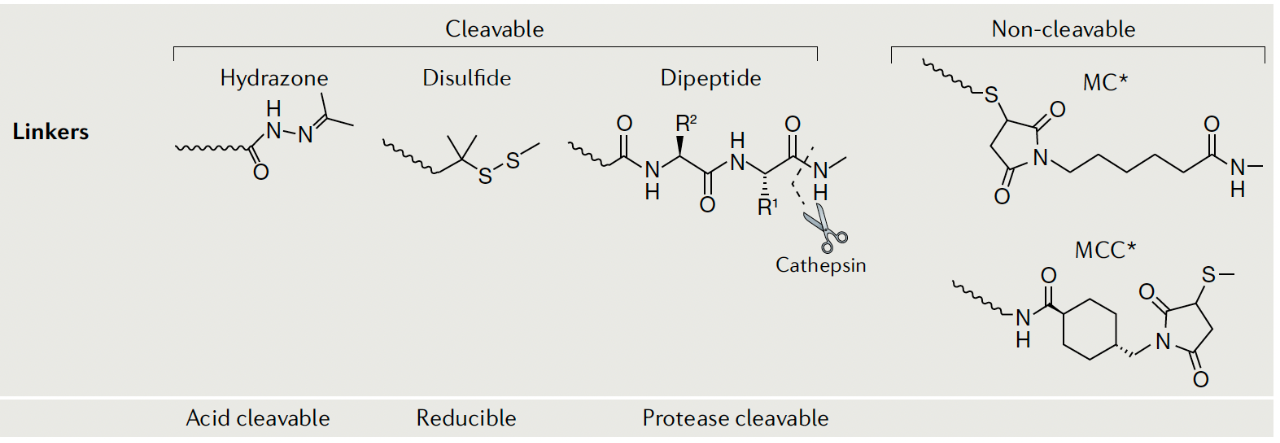
图片来自:Nat Rev Clin Oncol. 2021;327-344.
连接器大致分为两类:可切割型和不可切割型。当存在肿瘤相关因素(如酸性环境、丰富的蛋白质水解酶等)时,可切割连接器可以分解释放ADC细胞毒性负荷。可切割连接器有:PH敏感性连接子(例如:gemtuzumab ozogamicin),可还原性二硫键连接、各种基于肽的连接器、酶可切割连接器(如维布妥昔单抗、polatuzumab vedotin,戈沙妥珠单抗,T-DXd等)。
但在实际应用中,可切割连接器在血浆循环中的稳定性有所不同。gemtuzumab ozogamicin与其他可切割连接器相比,使用的连接器稳定性差,生理性差PH一定程度的水解也可能部分解释其脱靶毒性。
相比之下,不可切割的连接器在血浆中更稳定,但其抗体-连接器结构依靠溶酶体降解来释放载荷,这通常会导致载荷上的带电氨基酸保留,这可能会影响药物的疗效或细胞的渗透性。使用不可切割接器有:T-DM1,belantamab mafodotin。
值得注意的是,临床前研究数据显示,细胞毒性载荷的细胞外释放可能是ADC活性的重要组成部分,因此接头稳定性的优化是一个复杂的问题,以及靶点、载荷的选择,以及TME所有特征都有关。
载荷(payload)
早期的ADC研究使用传统化疗药物,如甲氨蝶呤、多柔比星、长春新碱等。然而,研究表明,这些研究表明,ADC它并不比它们的传统模式更有效。此外,数据还显示,只有少数抗体靶向剂量可以到达肿瘤组织(~0.1%)提示需要更强的细胞毒性负荷才能达到治疗效果。
所以,后续ADC对更高效的化疗药物进行研究,如:auristatins、calicheamicins、美登素(maytansinoids)、喜树碱衍生物(camptothecin analogues)等等,这些药物在亚纳摩尔浓度下表现出细胞毒性。
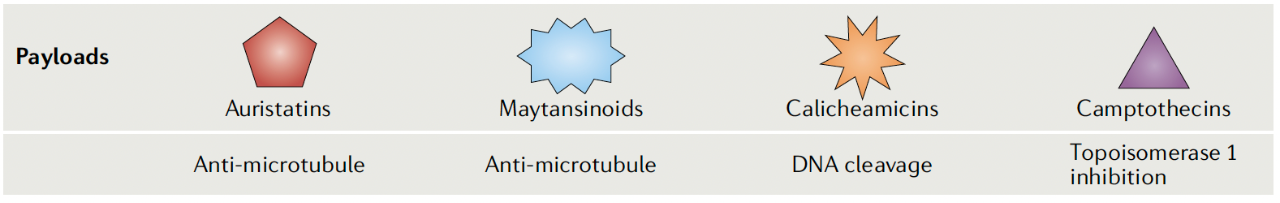
图片来自:Nat Rev Clin Oncol. 2021;327-344.
上述收获FDA批准的9个ADC中,单甲基auristatin E(MMAE)和单甲基auristatin F(MMAF)属于auristatins,是微管蛋白失稳剂。Ozogamicin属于calicheamicins,能导致双链DNA断裂。DM1属于美登素类化合物,能破坏微管蛋白的稳定性。DXd和SN-38它属于喜树碱衍生物,通过抑制拓扑异构酶I而导致DNA断裂。需要注意的是,这些载荷不适合作为游离药物全身运送。
药物-抗体比例(drug-to-antibody ratio,DAR),是指每个mAb载荷的平均数量与载荷的平均数量相同ADC药理学活性有关。目前已获批。ADC的DAR范围为2~8。一般来说,在体外试验中,高DAR ADC活性较高,但通过肝脏可能更快地从血浆中去除。以维布妥昔单抗为例,其体外活性和体外活性以及DAR相关。在小鼠模型中,DAR为8的ADC版本,血浆清除速度比DAR2版本快5倍,但其毒性增加,并没有显示出抗肿瘤活性的优势。
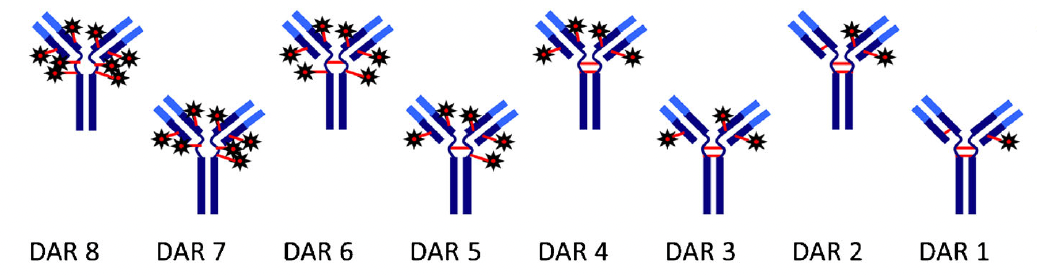
图片来自:Pharm Res. 20151907-19.
临床前研究表明,临床前研究较高DAR这种关系与较快的肝关系,以及抗体-通过使用亲水性结构,可以避免连接子复合物的疏水性增加。对于药物结构和药物结构。DAR不影响血浆清除率(如戈沙妥珠单抗)ADC更高DAR与体内抗肿瘤活性直接相关。

