嘉因生物SMA注册基因疗法临床试验获批
6月21日,杭州嘉因生物科技有限公司(以下简称嘉因生物)宣布自主研发。AAV基因疗法EXG注射液临床试验申请001-307,已获得中国国家食品药品监督管理局药品审评中心(CDE)经批准,计划开发用于治疗1型脊髓性肌萎缩症(1型)SMA活运动神经元1)(SMN1)基因双等位基因突变(缺失)。根据新闻稿,这是中国第一个静脉注射治疗1型,被批准进入注册临床试验SMA基因治疗产品。
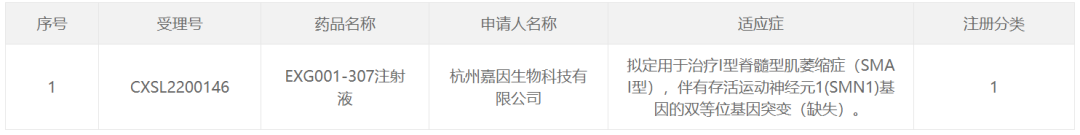
截图来源:CDE官网
脊髓性肌萎缩症(SMA)这是一种严重的进行性神经肌肉疾病。这种疾病通常由运动神经元生存蛋白引起(SMN)由功能异常引起的缺失。SMN缺乏蛋白质的程度,SMA可分为几种类型。其中,最严重的1型SMA由于神经元快速死亡和肌肉损伤,患者大多在24个月时死亡或需要永久性呼吸支持。
根据嘉因生物(ExegenesisBio)早期新闻稿,EXG001-307是一种新型的治疗方法SMA基因替代疗法预计一次给药将长期有效。其作用机制是正常表达SMN转基因蛋白装载AAV9在病毒载体中,增加它的生成SMN蛋白质的能力。这种设计旨在使患者在接受一次治疗后能够在细胞中长期表达SMN蛋白质,从而达到愈合的效果。此外,在产品开发过程中,嘉因生物采用了创新的设计,旨在减少基因治疗对儿童心脏和肝脏的副作用,更好地发挥基因治疗的效果。
早先,EXG浙江大学医学院附属儿童医院001-307注射液临床研究于今年3月完成了第一次受试者给药。根据嘉因生物早期新闻稿,药物的安全性和耐药性良好,接受治疗的儿童在临床医务人员的精心治疗和护理下成功出院。
公开资料显示,SMA儿童出生后6个月内,运动功能迅速退化,四肢对称无力,头部控制能力差,无法达到与正常发育相对称的运动功能。其典型特征是无法独自坐着,需要依靠手推车或轮椅,吞咽和喂养困难,可能是由于吸入(分泌物或食物进入肺部)窒息,也可能需要使用饲管摄入液体食物补充营养,儿童容易吸入性肺炎,大多数儿童死于呼吸衰竭。
参考资料:
[1]中国国家食品药品监督管理局药品审评中心(CDE)官网. Retrieved Jun 20,2022,from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]首个针对国内自主研发的1型SMA基因治疗药物IND批准临床试验. Retrieved Jun 21,2022. From https://mp.weixin.qq.com/s/SdGdX2JdlN9mNb9nK6Ct9g
[3]杭州嘉因针对1型SMA基因治疗临床研究的第一个受试者完成了给药并顺利出院. Retrieved Mar 26,2022. From https://mp.weixin.qq.com/s/-Iase96oqfhvdQJXvL3kZQ
