四代齐鲁制药EGFR首次申报临床抑制剂
6 月 16 日,据 CDE 官网显示,齐鲁制药的第四代 EGFR 抑制剂 QLH11811 首次申报临床。
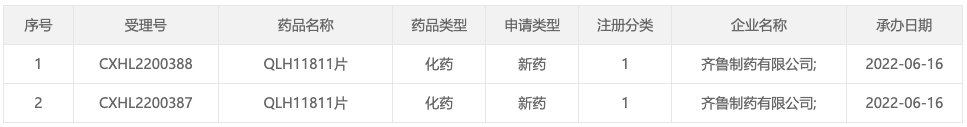
来自:CDE 官网
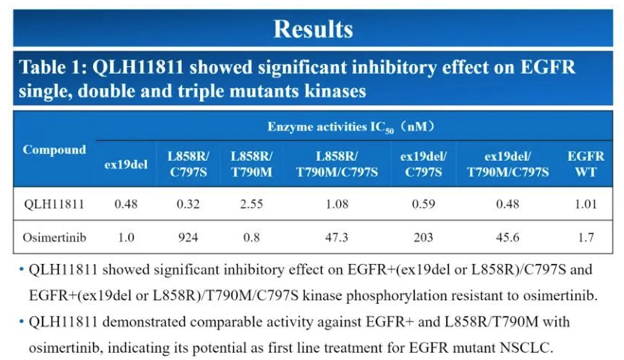
此前,在 2022 AACR 年会上,齐鲁首次公布了 QLH11811 的临床前数据。从数据来看,QLH1811 可逆转 C797S 突变,同时也可抑制常见的 ex19del、L858R 以及 T790M。此外,研究显示,QLH11811 降低了多个肿瘤异种模型中肿瘤的生长。
QLH11811 临床前数据
第三代 EGFR 抑制剂挑战重重
关于 EGFR 抑制剂,从 2003 年 FDA 批准第一个 EGFR 抑制剂开始,已从第一代抑制剂发展到第二代、第三代。
然而,当前三代 EGFR 抑制剂赛道也已异常拥挤,竞争进入白热化状态。当前同领域产品也非常活跃,国内首款获批上市的国产三代 EGFR-TKI 阿美替尼刚于昨日在英国申报上市,成为同类品种中首个出海的创新药。
不过三代抑制剂同样面临着耐药性的问题,且其耐药机制复杂,包括多种情况:可能是由于 C797S、G796D 等靶点获得性突变,也有 MET、K-ras 等促癌基因发生突变导致 EGFR 下游信号通路激活。此外,也会出现非小细胞肺癌向小细胞肺癌转化和上皮间质转化的情况。
其中,最主要的原因是 EGFR C797S 的突变,使得三代抑制剂无法与蛋白形成共价非可逆结合,降低药物与 ATP 的竞争活性。由此,主要靶向 C797S 突变的第四代 EGFR-TKI 抑制剂应运而生。
全球 7 款产品进入临床阶段
据 Insight 数据库显示,当前全球共有 18 款靶向 EGFR-C797S 的抑制剂。其中,7 款已进入临床阶段。
7 款靶向 EGFR-C797S 已进入临床阶段的产品
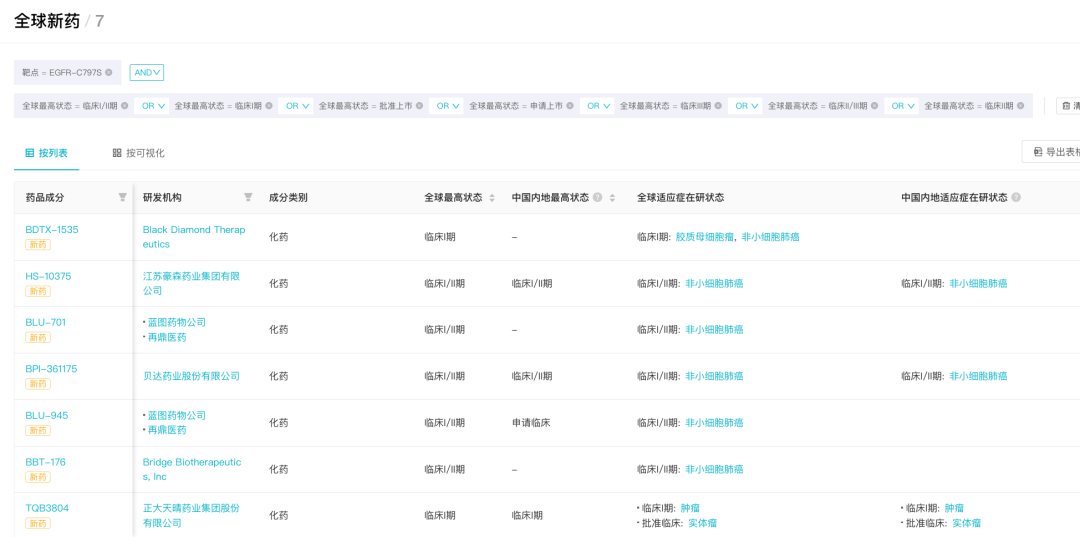
来自:Insight 数据库 全球新药模块(http://db.dxy.cn/v5/home/)
Blueprint Medicines:
BLU-945 和 BLU-701
Blueprint Medicines 当前拥有 BLU-945 和 BLU-701 两款口服可逆性选择性四代 EGFR 抑制剂。在抑制 EGFR 激活性和耐药性突变同时,不影响野生型激酶的活性。再鼎医药拥有这两款产品在大中华区的开发权益。
BLU-945 医药交易
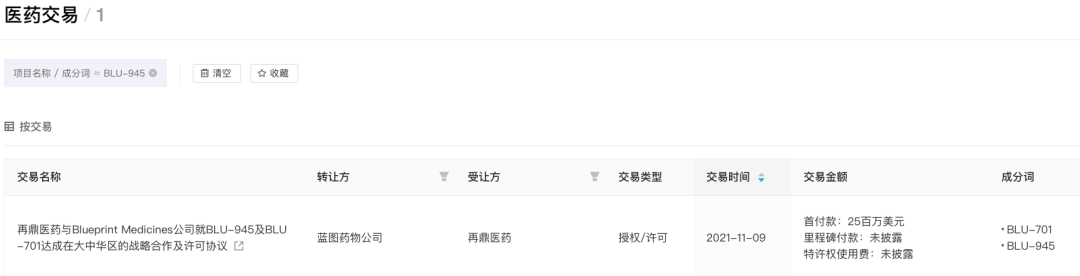
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
当前 BLU-945 和 BLU-701 均已进入临床阶段。在刚过去的 ASCO 会上,Blueprint Medicines 公司报道了 BLU-945 和 BLU-701 临床试验进展和入组和排除标准。同时公布了这两款产品的研究设计。
BLU-945 的 I/II 期研究(SYMPHONY)(摘要号:TPS9156),旨在评估 BLU-945 单药或联合使用奥希替尼的安全性和疗效数据。
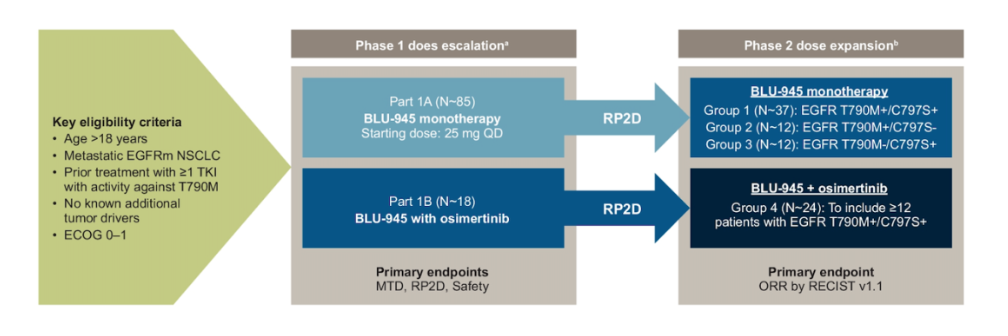
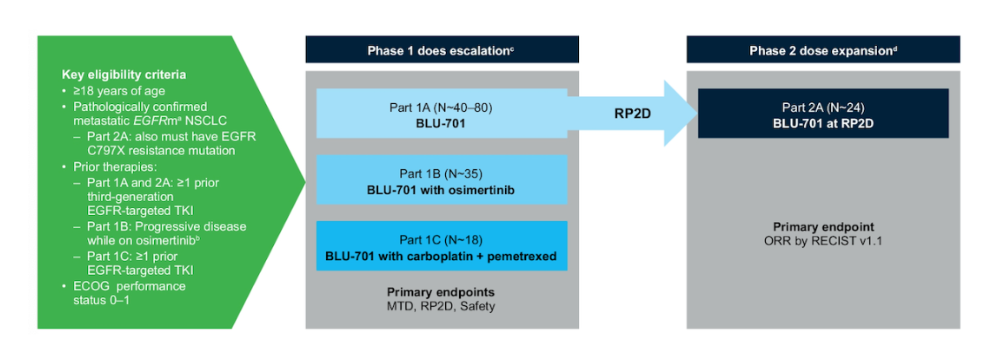
BLU-701 的 I/II 期临床研究(摘要号:TPS9142)旨在评估 BLU-701 单药,联合奥希替尼,联合化疗(卡铂+培美曲塞)的安全性和疗效。
在今年的美国癌症研究学会(AACR)会议上首次披露了 BLU-945 的 I/II 期SYMPHONY 试验数据(登记号:NCT04862780),这也是全球首次公布第四代 EGFR 抑制剂的临床数据。
SYMPHONY 试验
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
该试验的剂量递增阶段,共纳入了 33 例 EGFR 突变的 NSCLC 患者,包括 55% 的亚洲人。在这些患者中,97 % 的人此前接受过奥希替尼治疗,21% 接受过 1-2 种治疗方案,79% 的患者接受过 3 种及以上治疗方法。
这些患者的耐药基因 33% 为 EGFR 常见突变+T790M+C797S,还有 27% 的患者未检出 EGFR 突变。
患者基线特征
在安全性方面,33 例患者中与治疗相关的任何级别不良事件为:恶心(21%),头痛(3%),疲劳(15%)、咳嗽(3%)、呕吐(9%)、口干(9%)。此外,与治疗相关的 3 级不良反应有恶心(3%)和呕吐(3%)。无 4、5 级不良事件。8 例(24%)患者出现严重不良事件,其中只有 2 例(6%)被认为与 3 级呕吐和 3 级转氨酶升高有关。总体而言,与野生型 EGFR 相关的不良反应事件均较弱。
BLU-95 治疗 EGFR 突变 NSCLC 患者的不良反应
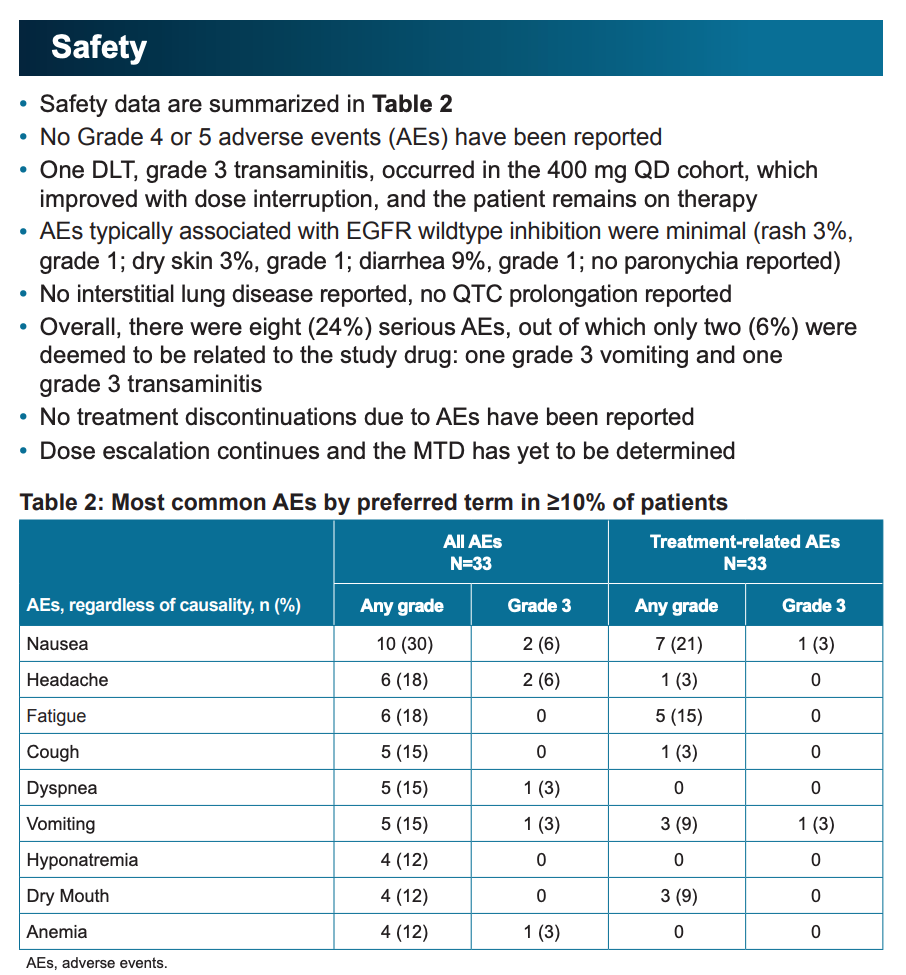
药代动力学分析显示,BLU-945 在人体内的半衰期为 24.1 小时,剂量越高,越能达到克服耐药突变所需的药物浓度。
对于 EGFR 19del/L858R+T790M+C797S 三重突变,25mg、50mg 等较低剂量也能在服药 15 天后达到 9 成抑制浓度(IC 90)。对于 L858R +/- C797S 则需要至少 100 mg 剂量才能在服药 15 天后达到 IC 90。而对于 19del +/- C797S,400 mg 剂量服药 15 天,依旧无法达到 IC 90,这与临床前研究结果吻合。
药代动力学结果
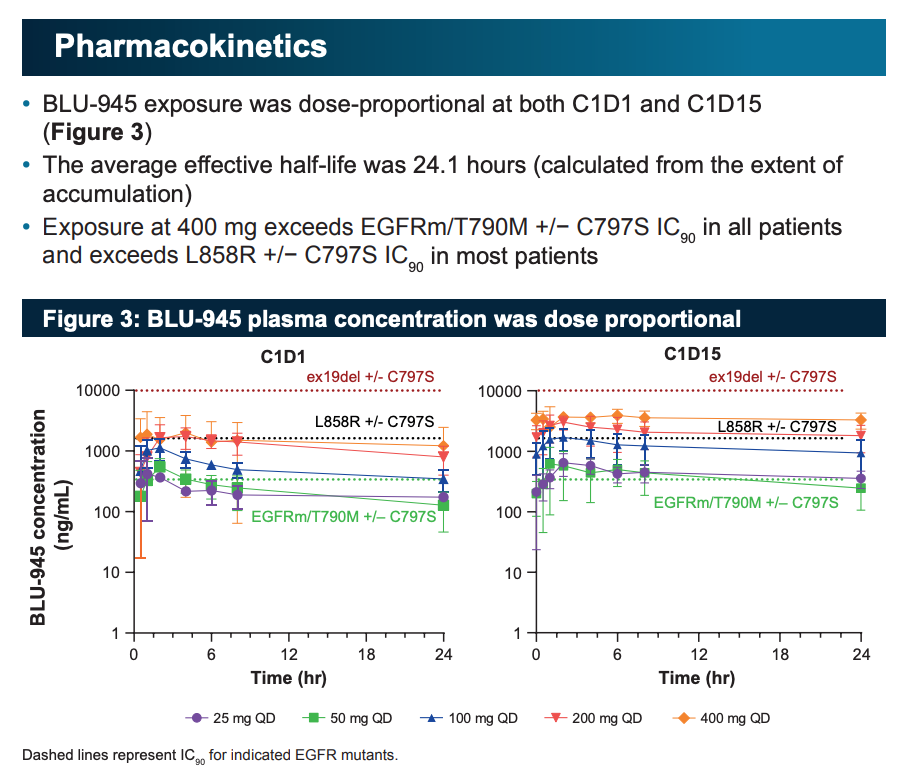
在临床疗效方面,试验结果显示,83% 携带 T790M 突变患者服用 BLU-945 后 T790M 的 ctDNA 降低了,81% 携带 C797S 突变患者服用 BLU-945 后 C797S 的 ctDNA 降低了。其中剂量水平为 400 mg时,所有患者 T790M 和 C797S 的 ctDNA 都降低了,有 3 例完全清除。
BLU-945 治疗 EGFR 患者的临床疗效
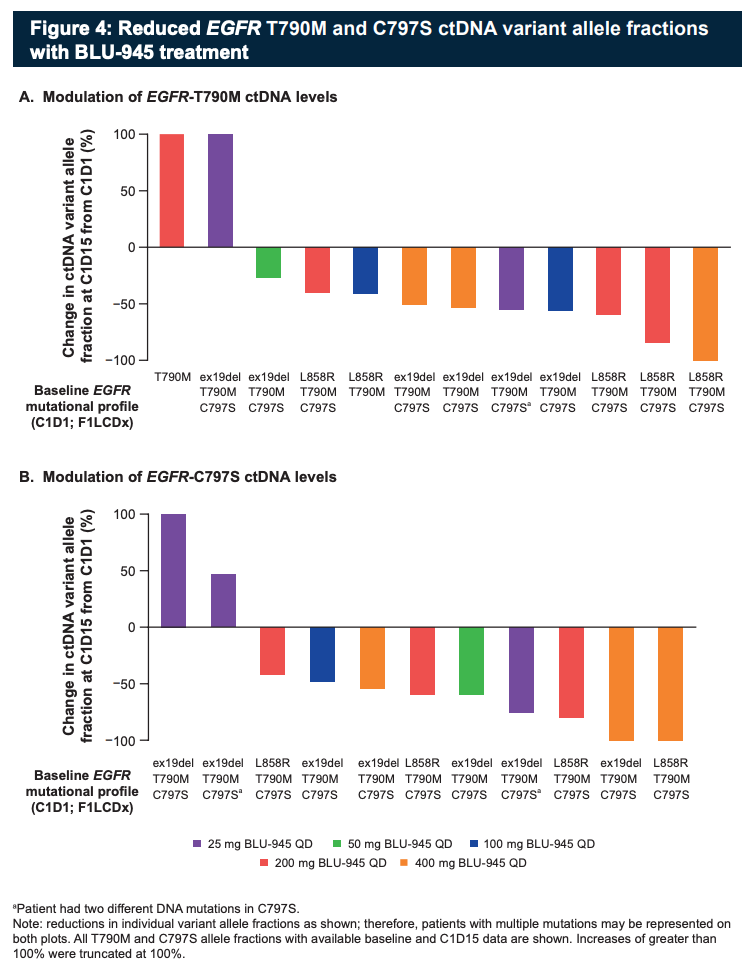
肿瘤体积评估显示,有 2 例 19del + T790M + C797S 三重突变患者,接受 400 mg 每天一次 BLU-945 治疗时,肿瘤明显缩小,但是否达到部分缓解有待确认。
不同剂量患者的肿瘤随时间变化情况
总体而言,BLU-945 是一种高效、选择性的第四代口服抑制剂。可减少 C797S 等耐药基因的 ctDNA,以及在 200mg 及以上剂量能明显观察到患者的肿瘤缩小。不过,由于 BLU-945 对 ex19del 的抑制作用较弱,需与其他药物联用。所幸 BLU-945 的耐受性良好,且不良反应轻微,支持开展与其他药物的联用。
据悉,BLU-945 后续将与奥希替尼开展联合给药,两家公司已经签订临床合作协议。
贝达药业:BPI-361175
去年 5 月,BPI-361175 在国内首次启动临床,开展了一项评价 BPI-361175 片在晚期实体瘤患者中安全性、耐受性、药代动力学和有效性的剂量递增、开放的 I/II 期研究(登记号:CTR20210966),该试验目前仍在开展中。
同年 12 月,BPI-361175 用于治疗携带 EGFR C797S 突变及其他 EGFR 相关突变的非小细胞肺癌的临床试验申请获 FDA 批准,当前在 ClinicalTrials.gov 已登记有两项试临床试验(登记号:NCT05393466、NCT05329298)。
BPI-361175 全球研发进展甘特图
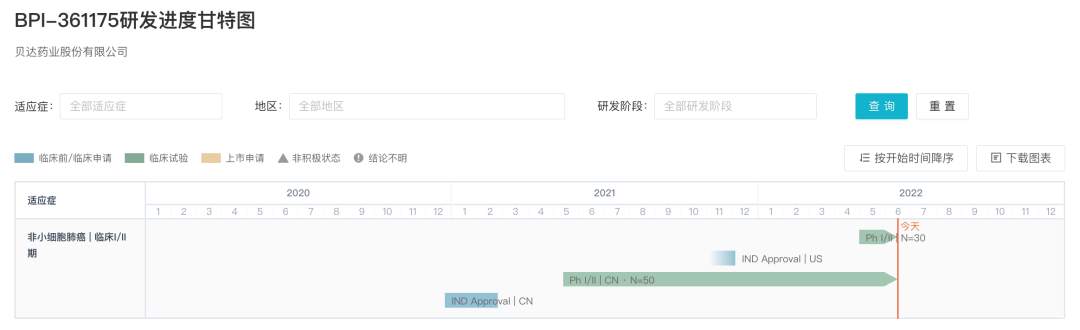
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
BPI-361175 作用机理图
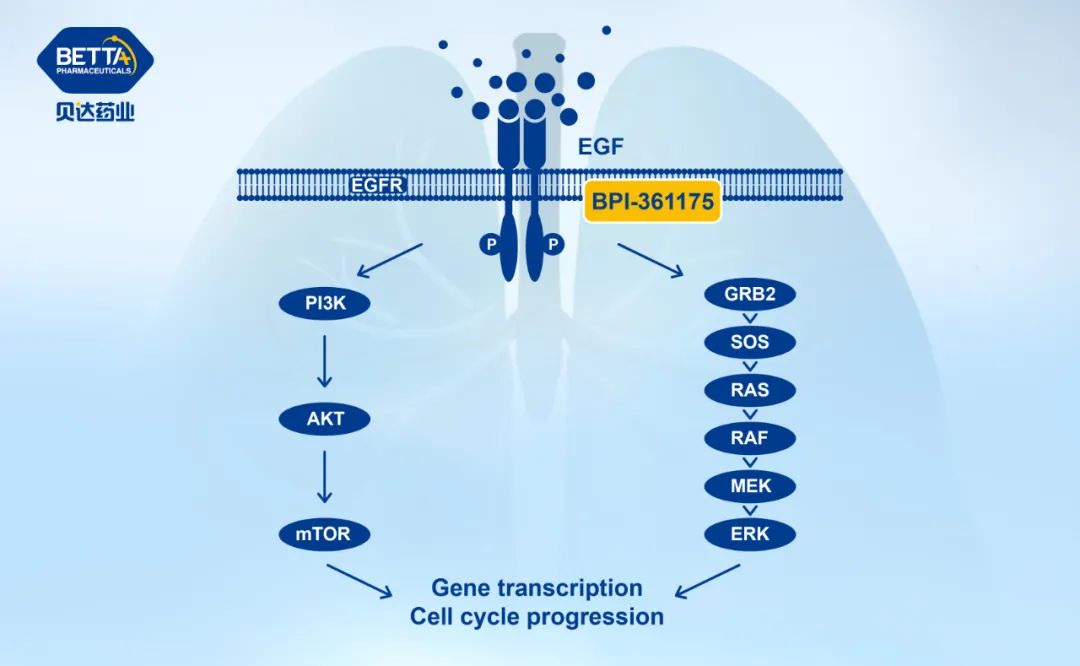
来自:贝达药业官微
此前披露的临床前数据显示,BPI-361175 体内外生物学活性一致,可有效抑制携带 EGFR C797S 突变肿瘤细胞的增殖,并在多个携带 EGFR 相关突变的移植瘤模型上展现了良好的抗肿瘤作用。
BPI-361175 可显著抑制三突变、双突变以及单突变多种不同突变 EGFR 激酶的活性以及携带相应突变的细胞 EGFR 磷酸化和细胞增殖。
同时,在细胞和激酶水平上 BPI-361175 对 EGFRWT 和 IGF1R 均无明显抑制,表现出良好的选择性。在体内,口服 BPI-361175 能够抑制多种不同 EGFR 突变肿瘤的生长并使其消退。
值得注意的是,BPI-361175 具有良好的脑穿透能力,可显著延长 BaF3 EGFRDel19/T790M/C797S 脑原位模型小鼠的生存期。
Bridge Biotherapeutics:BBT-176
BBT-176 同样是一款 EGFR-C797S 抑制剂。研究显示,BBT-176 在携带包括 C797S 在内的三重突变(Del19/T790M/C797S,和 L858R/T790M/C797S)的异种移植动物模型中表现出强力的抗癌活性。BBT-176 与抗 EGFR 抗体联用,活性显著增强。
目前,Bridge Biotherapeutics 公司正在开展一项 I/II 期临床,探索 BBT-176 单药及联合利妥昔单抗的安全性、耐受性、和疗效。
BBT-176 全球研发进展甘特图

来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
正大天晴:TQB3804
据 Insight 数据库显示,正大天晴的 TQB3804 于 2019 年 04 月首次申报临床,同年 11 年启动临床。
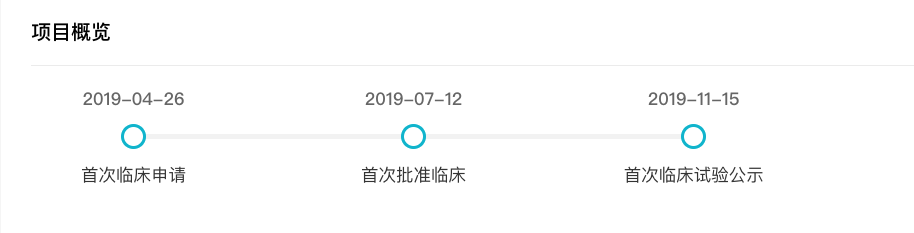
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
TQB3804 除了可以解决奥希替尼耐药,还对 1/2 代 TKI 耐药后的 T790M 双重突变有疗效。此前研究显示,TQB3804 对于 d746-750(19del)/T790M/C797S、L858R/T790M/C797S、d746-750/T790M 及 L858R/T790M 的 IC50 值为 0.46、0.13、0.26 及 0.19nM,提示对于 1/2/3 代 TKI 耐药后出现 EGFR 三重及二重突变的肿瘤细胞都有不错的抑制能力。
TQB3804 在 19del/T790M/C797S 的不同模型中,都能较好地延缓肿瘤的增长。当前正在开展一项 TQB3804 在晚期恶性肿瘤患者中的剂量递增及扩展的 I 期临床研究。
TQB3804 全球研发进度甘特图
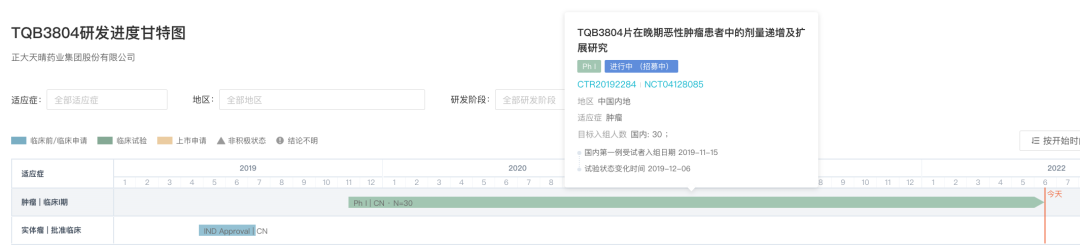
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
Black Diamond Therapeutics:BDTX-1535
Black Diamond Therapeutics 的 BDTX-1535 于今年 1 月获 FDA 批准进入临床阶段,约一个月后启动了一项评估口服 EGFR 抑制剂 BDTX-1535 在胶质母细胞瘤或非小细胞肺癌患者中的疗效的 1 期研究(登记号:NCT05256290)。当前试验正在招募患者中,预估 2024 年 9 月完成该试验。
NCT05256290 临床试验
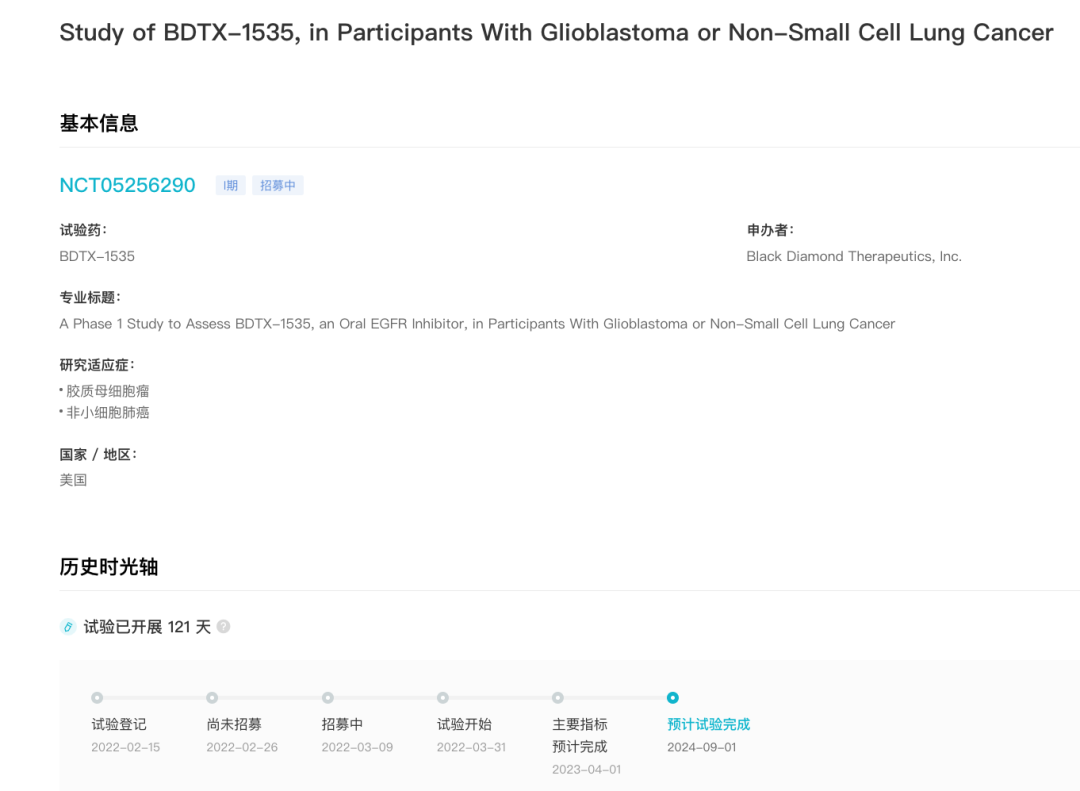
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
翰森制药:HS-10375
HS-10375 是翰森制药自主研发的一款四代 EGFR 抑制剂。当前正在开展一项评估 HS-10375 在晚期非小细胞肺癌患者中的安全性、耐受性、药代动力学和有效性的I/II 期临床研究(登记号:CTR20220045)
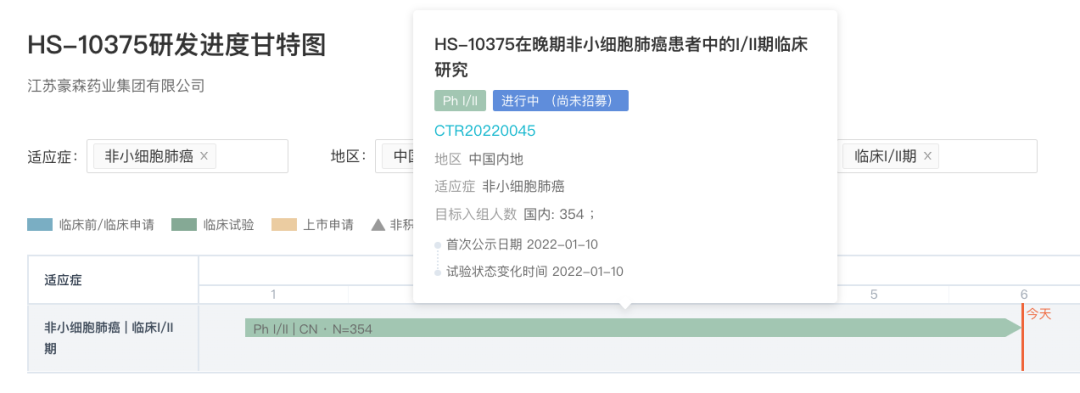
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
除小分子抑制剂外,针对第三代 EGFR 抑制剂的耐药问题,其他疗法诸如 ADC 也有望提供解决方案,如第一三共的 HER3 ADC 药物 Patritumab deruxtecan(U3-1402)。U3-1402 采用第一三共公司专有的 DXd ADC 技术设计,将抗 HER3 抗体 Patritumab 与拓扑异构酶抑制剂 DX-8951(依喜替康)通过一个四肽连接子连接。
Patritumab deruxtecan(U3-1402)简介
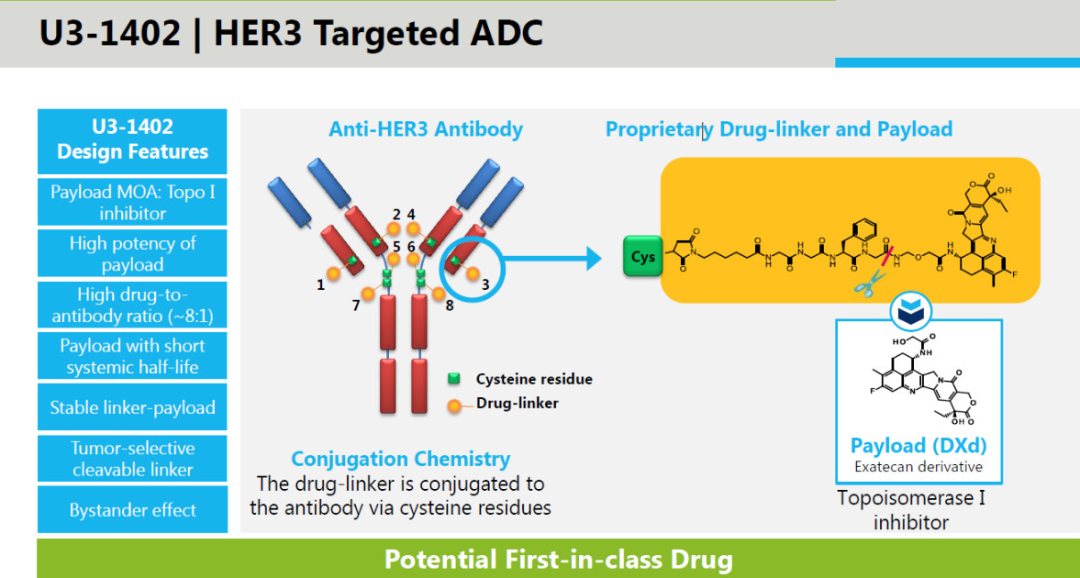
来自:第一三共官网
在今年的 ASCO 大会上,U3-1402 公布了针对乳腺癌的临床数据。此前该药在 NSCLC 领域公布的早期临床数据(NCT03260491)也是非常亮眼,该项数据在 2021 ASCO 大会上发表。
试验中共有 57 例 NSCLC 患者接受了 U3-1402 5.6 mg/kg 每三周一次的治疗,之前均接受过 EGFR TKI 治疗,86% 奥希替尼,91% 含铂化疗,40% 免疫治疗,中位治疗线程 4,脑转移 27 例(47%)。
经确认的客观有效率 39%,疾病控制率 72%,中位缓解持续时间 6.9 个月,中位无进展生存期 8.2 月。其中 44 例之前接受过奥希替尼和含铂化疗的患者,经确认的客观有效率 39%,疾病控制率 68%,中位缓解持续时间 7.0 个月,中位无进展生存期 8.2 月。
值得注意的是,该研究在 EGFR C797S 突变、MET 基因扩增、HER2 突变和 BRAF 融合患者中均观察到肿瘤部分缓解。这意味着此款产品若后续开发顺利,很可能具有「通用」潜力。对于 EGFR 抑制剂耐药的患者而言,无疑是个好消息。
去年 12 月,FDA 已经授予 patritumab deruxtecan(HER3-DXd;U3-1402)突破性疗法认定(BTD),用于治疗接受第三代酪氨酸激酶抑制剂(TKI)和含铂疗法治疗期间或治疗后,发生疾病进展且携带耐药性 EGFR 突变的转移性或局部晚期非小细胞肺癌(NSCLC)患者。
据 Insight 数据库显示,针对 NSCLC 适应症 patritumab deruxtecan 刚于 5 月 10 日启动一项 III 期临床试验(登记号:NCT05338970)。
patritumab deruxtecan III 期临床试验
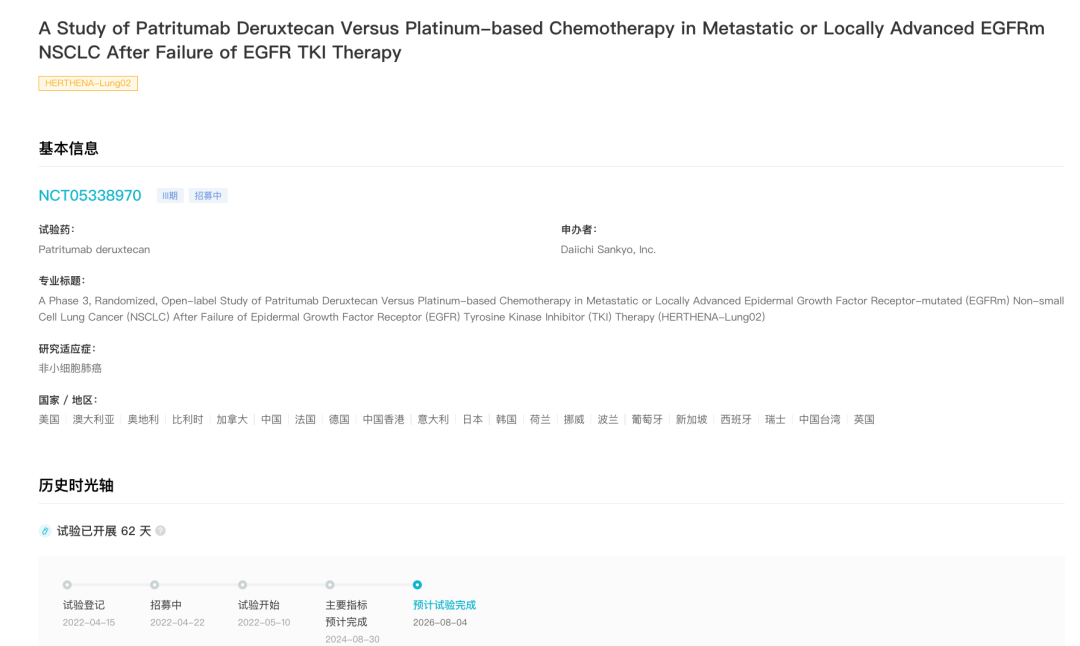
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
