聚焦药靶:KRAS战争一触即发,谁能笑到最后?
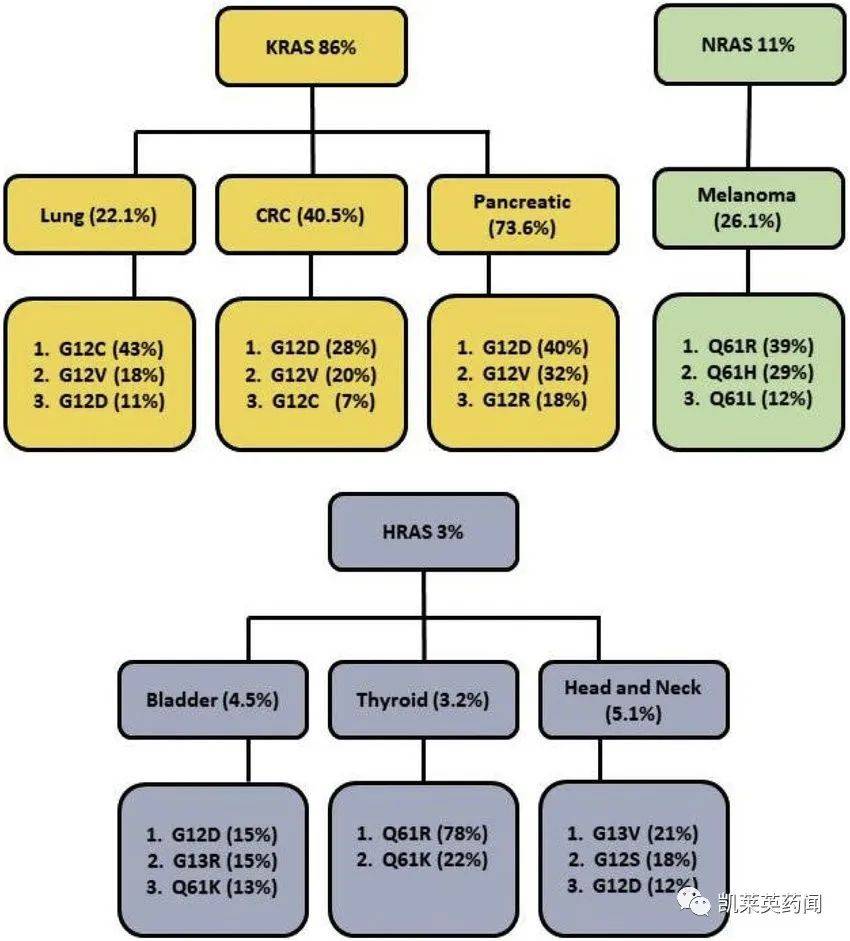
1982 年,KRAS(Kirsten-RAS)这是第一次被发现为与人类肿瘤有关的致癌基因RAS 家族的另外29名成员NRAS (neuroblastoma-RAS) 和HRAS (Harvey-RAS)。NRAS、HRAS 和KRAS1、11 和12号染色体分别定位。KRAS188~1899个单个氨基酸组成的纯蛋白,相对分子质量为21000。研究发现,RAS它是肿瘤中最常见的突变基因之一,KRAS 亚型又是RAS 3 亚型中突变最频繁的亚型,KRAS基因突变约占所有肿瘤突变的30%。KRASG12C突变占所有非小细胞肺癌(NSCLC)病例比例约为59%,占所有癌症的比例KRAS12%的突变病例。KRAS基因变异主要发生在基因变异G12、G13、Q三个位点61.G12位点,KRAS高频变异之一是G12C。
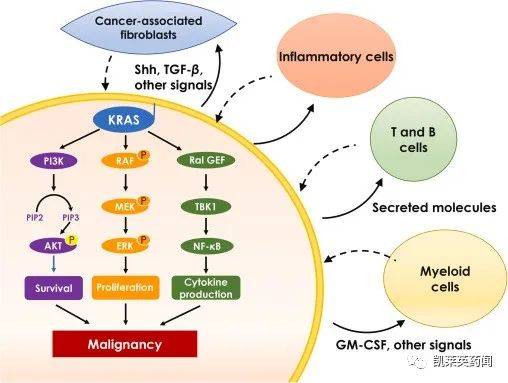
KRAS 作为一种信号传感器,可以将上游信号分子的刺激信号传递到细胞中,从而调节细胞的生命活动,如增殖、分化、生存和凋亡。KRAS蛋白质可以被生长因子和趋化因子Ca2.或酪氨酸激酶(TK)激活,激活,激活KRAS 蛋白质可以激活磷脂酰肌醇3-激酶酶(PI3K)-蛋白激酶B(AKT)-帕霉素靶蛋白(mTOR)、Ras-纤维肉瘤的快速加速(Raf)-原活化蛋白激酶分裂(MEK)-蛋白激酶在细胞外调节(ERK)、鸟类嘌呤核苷酸解离刺激因子(RalGDS)- Ras 样蛋白(Ral)及 Ras 同源蛋白(Rho)/Ras 相关C肉毒毒素底物3.(Rac)等信号通路。
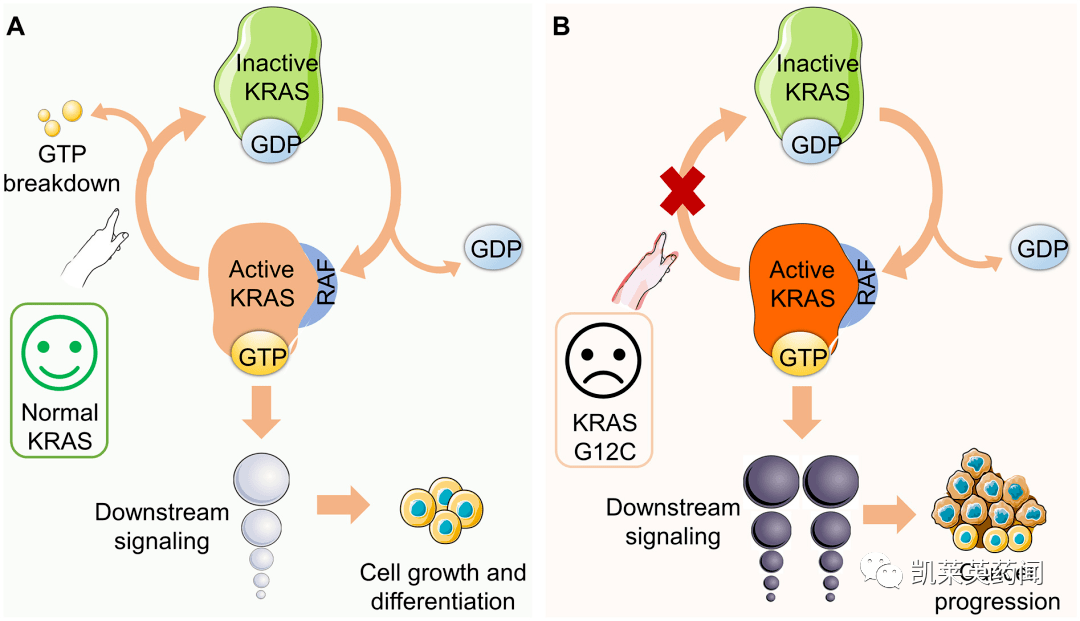
肿瘤发展是人类癌症谱系中最常见的驱动因素之一,KRAS 的发现是癌症研究中的一个关键里程碑。在发现这一目标后的几十年里,没有直接的目标KRAS而抑制其异常功能的药物,使KRAS曾经被认为是不可成药的靶标,主要有以下原因:①KRAS 与底物GTP 的组合非常强烈,亲和系数达到皮摩尔浓度(10-12),而正常细胞中GTP浓度达到微摩尔浓度(10-6)。这也使得直接靶向GTP口袋(pocket)竞争抑制剂难以开发;②随着KRAS不断分析,研究发现,KRAS 蛋白质表面类似于一个光滑的圆球,缺乏药物结合的口袋;③KRAS除了驱动肿瘤的发生和发展,针对性突变型也是正常细胞活动所必需的蛋白质KRAS活性位点的小分子通常可以抑制野生分子KRAS活性,因此表现出较大的毒性和不良反应。直到2021年52月,FDA批准靶向抗癌药物Lumakras(sotorasib)上市,揭开KRAS 抑制剂研发的序幕。目前有大量的抑制剂。KRASG12C突变变构调节剂pan-KRAS 抑制剂和KRAS(ON)在临床研究阶段相继发现了抑制剂和多种药物。
一、最新的研究进展
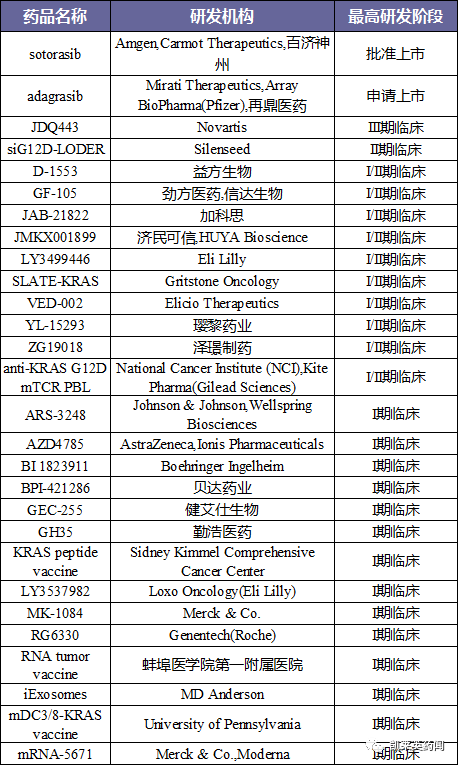
1.据不完全统计,目前正在全球研究中KRAS有90多种抑制剂,其中一种被批准上市,一种被申请上市,III期临床1个,II期临床1个,I/II期临床10个,I临床14个,临床2个,临床60个。
2.在适应症方面,主要是肿瘤适应症,包括结直肠癌、非小细胞肺癌、胰腺肿瘤、导管腺癌、胃肠道肿瘤、卵巢癌等。此外,它还涉及糖尿病视网膜病变和年龄相关性黄斑变性。
3、研究企业,包括Revolution Medicines、Singh Biotechnology、Mirati Therapeutics、Wellspring Biosciences、Erasca、Array BioPharma、Eli Lilly等等;此外,国内企业加科思、百济神州、再定、益方、金芳、信达、思路迪、济民可信、玛丽、泽靖、信诺维、贝达、亚盛等。都在这个领域。
4、目前处于临床以上阶段的药物统计如下:
二、介绍重点药物
随着Lumakras被FDA批准用于KRAS G12C二线突变疗法,KRAS这个曾经不可成药的靶点已经成为新药研发的热点。最近举行的2022ASCO、2022 AACR中,KRAS抑制剂频频出现,吸引着人们的目光。KRAS随着相关产品的陆续获批,未来的市场竞争将一一揭晓。
1、安进:sotorasib
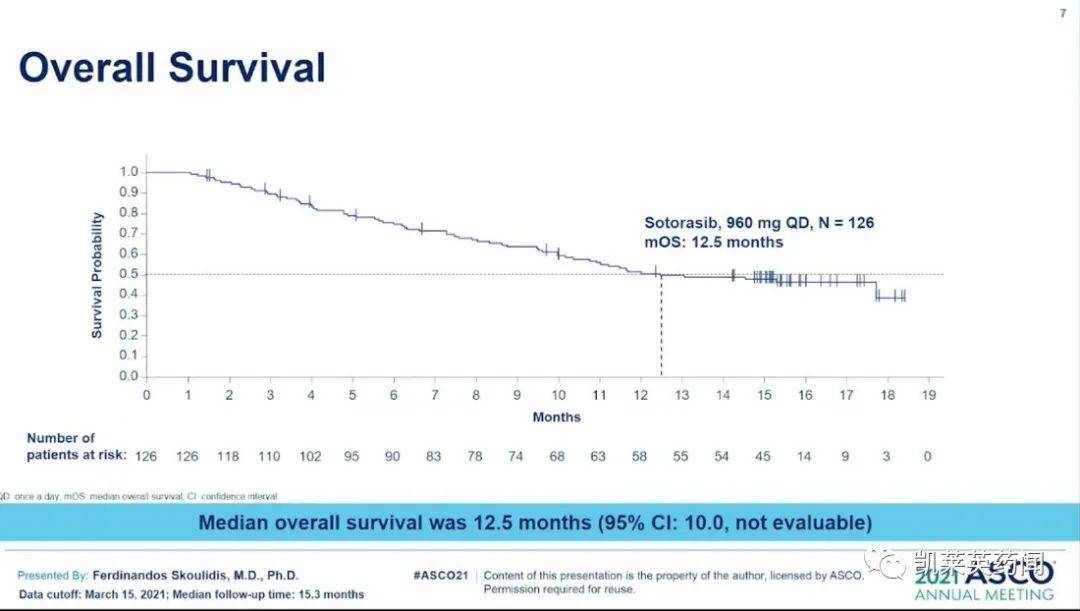
Lumakras它是由安进开发的,第一个也是唯一一个被批准用于治疗和携带的KRAS G12C局部晚期或转移性突变NSCLC截至目前,全球35个国家已批准患者靶向治疗,百济神州拥有该产品在中国的开发权益。CodeBreaK到目前为止,已经进行了100的研究KRAS G12C最大的临床试验是在突变患者中进行的,包括124例接受免疫治疗和/或化疗后病情的进展KRAS G12C突变阳性NSCLC病人队列的数据显示,Lumakras具有良好的疗效和耐受性,每天口服960次mg Lumakras在治疗患者中,客观缓解率,(ORR)为37.1%(95%CI:28.6-46.2),中位缓解持续时间(DoR)为11.一个月,疾病控制率(DCR)为80.6%,中位总生存期(mOS)为12.5个月。最常见的不良反应是腹泻(34%)、恶心(25%)、疲劳(21%)≥3级)不良反应为丙氨酸转氨酶水平升高(ALT;天冬氨酸转氨酶水平上升5%)(AST;4%)腹泻(4%)sotorasib国家药品监督管理局(NMPA)药品审评中心(CDE)它被列入突破性治疗药物,用于治疗那些至少接受过一次系统性治疗并携带了它的人KRAS G12C局部晚期或转移性突变NSCLC患者。根据Fierce Pharma预测,2025年的sotorasib预测市场为13亿美元,实力不容小觑。
2、Mirati:adagrasib
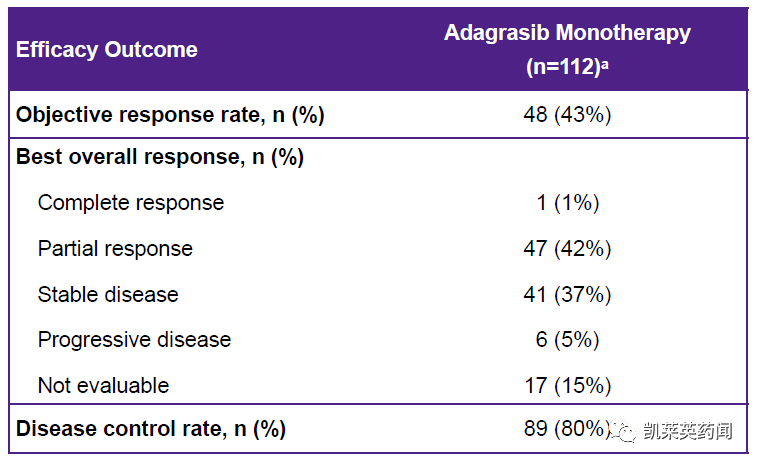
Adgrasib 是有Mirati一种在研究、高选择性和高效的开发KRAS G12C优化后,口服小分子抑制剂保持靶点抑制,因为 KRAS G12C 蛋白每24-48小时再生一次。这个属性是治疗KRAS G12C突变性癌症非常重要。Adagrasib 正在被评估为单一治疗,并与其他抗癌抗癌疗法结合使用KRAS G12C非小细胞肺癌、结直肠癌、胰腺癌等突变性实体瘤患者。2021年6月,再鼎医药预付6500万美元,总价33美元.38亿美元获adagrasib大中华区(中国大陆、香港、澳门、台湾省)的独家权益已引入中国食品药品监督管理局药品审评中心(CDE)提交的adagrasib申请临床试验。根据2022ASCO公布的数据:携带KRAS G12C晚期/转移性突变NSCLC在以前接受免疫治疗和化疗的116名患者中KRAS G12C 突变NSCLC病人入组和adagrasib治疗,12随访时间为12.5个月。结果显示,ORR(BICR)为42.9%(48/112)疾病控制率为.5%(89/112)患者仍在接受中位治疗。DOR为8.5个月,中位PFS为6.5个月,中位OS为12.六个月。根据目前公布的数据,adagrasib看起来略好于 sotorasib。
3、诺华:JDQ443
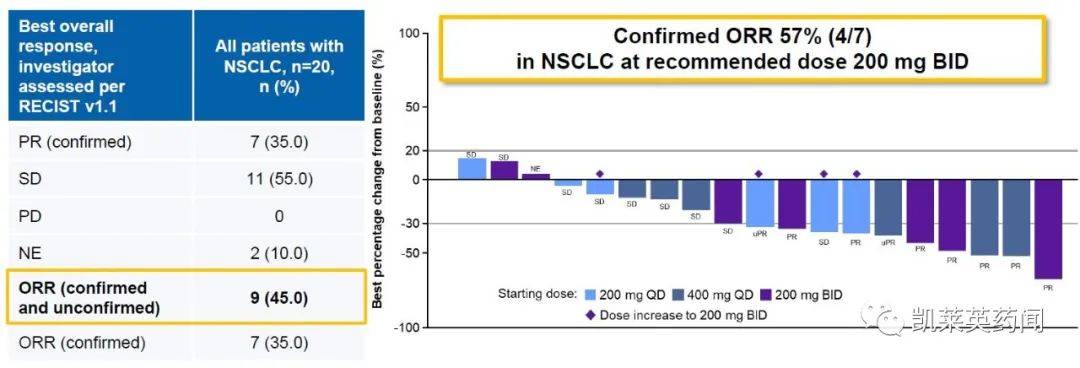
JDQ443是诺华开发的一种选择性口服KRAS G12C 抑制剂,可以不可逆地使用KRAS G12C突变捕获在非活动中,GDP结合状态。临床前研究表明,JDQ443可潜在抑制KARS G12C信号通路,并显示抗肿瘤活性的剂量依赖。根据2022AACR公布的数据:在一个项目中Ib/II期间、开放标签、多中心、剂量增加和剂量增加(KontRASt-01),探索JDQ443单一疗法或联合疗法TNO155(SHP2抑制剂)和/或PD-1单克隆抗体的疗效。剂量增加的主要目的是安全性和耐受性,并确定最大耐受性 (MTD) 和/或推荐剂量。剂量扩大的主要目的是疗效。结果显示,截至2021年,截至2021年12月139日NSCLC(共39例)患者,RECIST 1.1.标准研究者评价ORR(不同剂量水平和推荐剂量水平).2000%(3/7)mg BID确认剂量水平ORR达到57%。TRAE为1-2级,4例(10.3%)患者发生3级TRAE,无4-5级TRAE发生。说明JDQ443 显示可接受的安全性和耐受性NSCLC患者显示出良好的抗肿瘤活性。
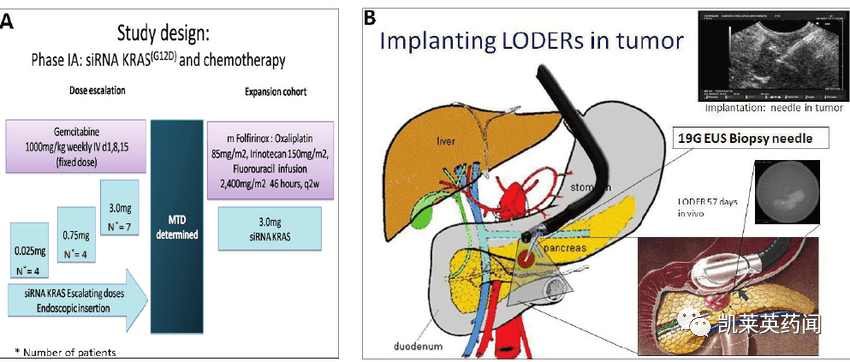
4、Silenseed:siG12D-LODER
siG12D-LODER它是一种可生物降解的聚合物基质,含有针对性KRASG12D的siRNA,临床研究表明,EUS引导下肿瘤植入siG12D-Loder联合化疗,治疗后12例局部晚期胰腺癌患者,10例病情稳定,2例部分缓解,中位总生存时间为15.一个月内,4名患者出现严重不良反应,表明聚合物可以靶向肿瘤,抑制肿瘤进展。目前,诺华正在瞄准siG12D-LODER为了测试下一步的研究siG12D-LODER局部晚期胰腺癌患者与化疗药物(如吉西他滨和紫杉醇)联合治疗。
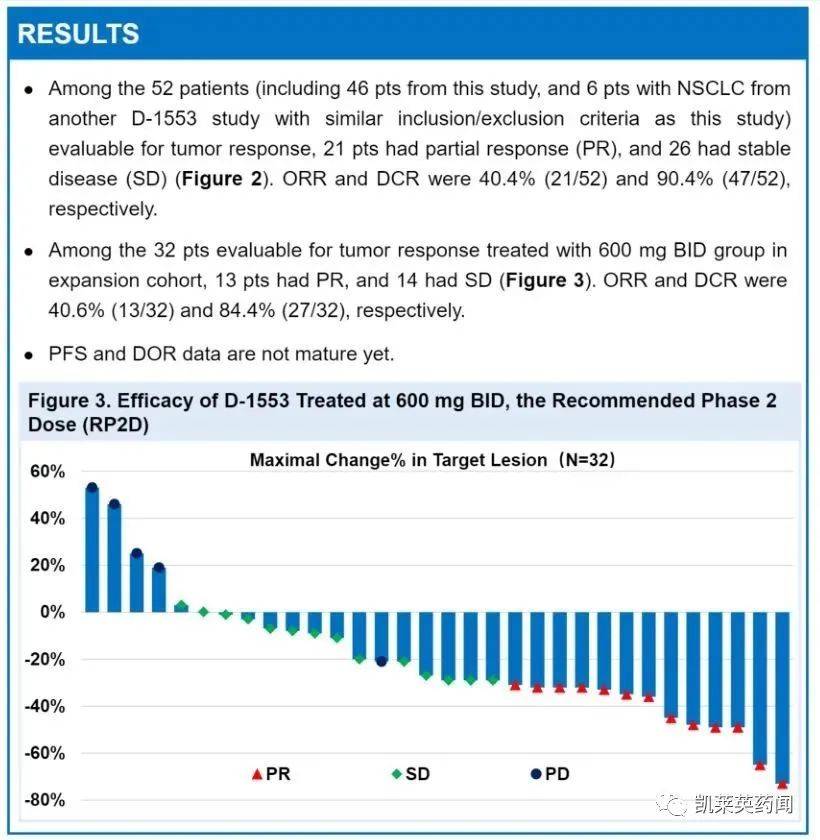
5、益方生物:D-1553
D-1553是益方生物自主研发的一种新型,高效口服KRAS G12C抑制剂。2022 AACR在年会上,益方首次宣布其口服KRAS G12C抑制剂D-1553I期间数据显示在一个项目中KRAS G12C国际多中心一期研究突变性晚期或转移性实体瘤患者,D-在22例患者中,1553具有良好的耐受性,无任何剂量限制性毒性;在21例可评估患者中,观察到19例.0%确认的肿瘤客观缓解率达到85%.疾病控制率为7%。另外,每天的剂量水平低至300mg已经观察到肿瘤缓解。
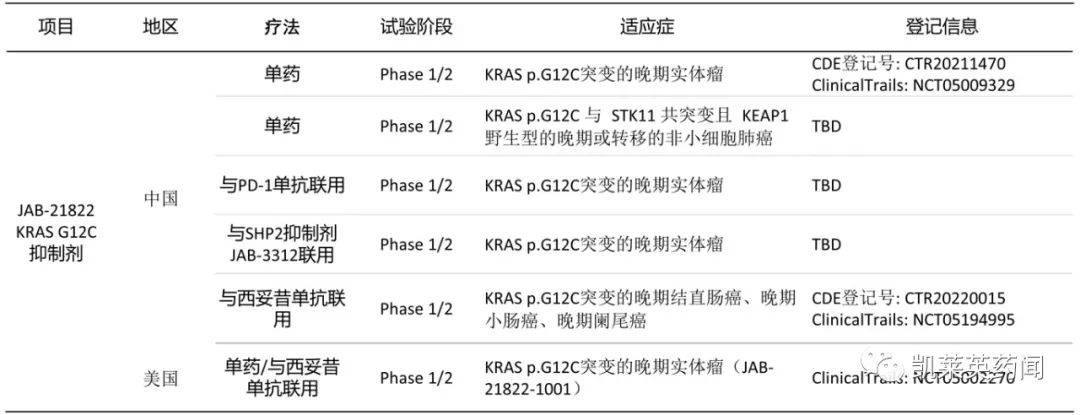
6、加科思:JAB-21822
JAB-21822是加科思自主研发的KRAS G12C抑制剂。临床前研究数据表明,它可以单独使用,治疗包括治疗KRAS G12C突变性实体瘤,同时KRAS G12C耐药治疗后,联合抑制剂治疗SHP2抑制剂有望有效地克服和逆转KRAS抑制剂2ASCO根据上公布的一期临床资料显示,截至2022年4月1日,共同入组KRAS G12C32例非小细胞肺癌突变患者,ORR为56.3%(18/32),DCR为90.400%(29/32)mg/d及800mg/d在剂量组中,ORR为66.7%(8/12),DCR100%(12/12)JAB-21822在剂量限制毒性(DLT),400mg/d及800mg/d剂量组中级或四级治疗相关不良反应为2.5%(1/40)JAB-21822具有良好的耐受性和有效性。