硝烟四起!CDK乳腺癌药物4/6抑制剂Ibrance再受挫 礼来,恒瑞一众药企蠢蠢欲动
文 | Osher
2022年,最近备受关注ASCO会议即将结束,几种重型乳腺癌药物已经公布了最新的临床数据,但表现却各不相同,有人欢喜有人忧。
其中,辉瑞公布了三期PALOMA-试验的最终总生存期(OS)分析数据,但结果令人失望。与安慰剂来曲唑相比,其结果令人失望CDK4/6抑制剂Ibrance(palbociclib,来曲唑的一线治疗未能延长患者的寿命。这次挫折导致Ibrance它是唯一一个在第三阶段临床试验中没有成功的模型OS结果的CDK4/6抑制剂。
这并不是Ibrance第一次在OS指标受挫。Ibrance联合阿斯利康激素疗法Faslodex(氟维司群)在3期PALOMA-3.试验中未能实现改进OS的目标,且Ibrance在PALLAS和PENELOPE-B同样的失败也发生在三期试验中。
在HR /HER2-晚期乳腺癌治疗领域,CDK4/6抑制剂的出现迅速改变了晚期乳腺癌的治疗模式,成为近年来各大企业的热门目标。
然而,作为世界上第一个被批准上市的CDK4/6抑制剂,辉瑞Ibrance如今,除了适应症的不断扩张,它还面临着许多危机。专利悬崖即将来临。它没有抓住医疗保险的机会,销售额正在下降,仿制药企业正在关注…
全球五款CDK4/6抑制剂被批准上市
全球首发,恒瑞达尔西利抢国产NO1
作为抗肿瘤靶向药物的新贵,CDK4/6抑制剂的竞争异常激烈。放眼全球,已经有五款了CDK4/6抑制剂被批准上市,分别是辉瑞哌柏西利、诺华瑞波西利、礼来阿贝西利、G1 Therapeutics/曲拉西利和恒瑞制药达尔西利。除曲拉西利外,其他四种药物适应症均为HR /HER2-乳腺癌。
其中,哌柏西利、阿贝西利和达尔西利已被批准在中国上市,瑞波西利和曲拉西利已于2021年上市NMPA上市申请单独提交上市申请。具体情况如下:
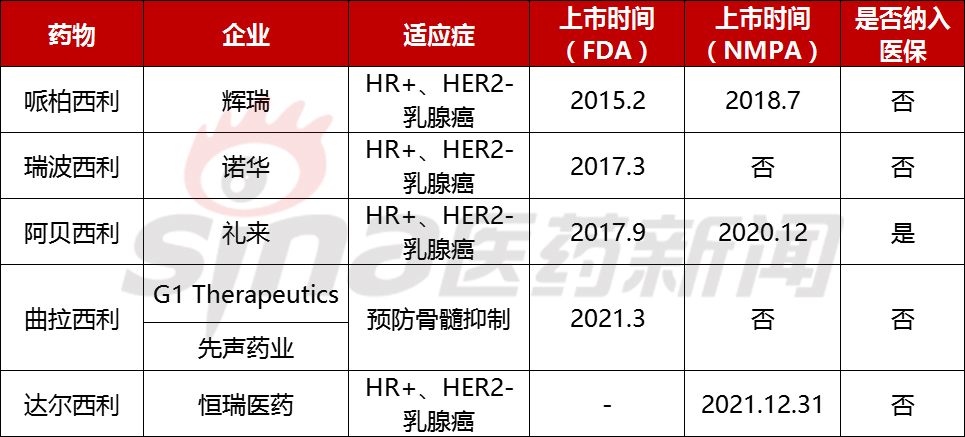
?辉瑞哌柏西利(Ibrance):全球首款CDK4/6抑制剂
原研究的哌柏西利是世界上第一款CDK4/6抑制剂。2015年,FDA结合来曲唑治疗,通过快速审批程序批准哌柏西利上市ER 、HER2-女性乳腺癌绝经后患者。
2018年7月,NMPA批准上市,用芳香化酶抑制剂作为局部晚期或转移性HR ,HER2-初始内分泌治疗女性乳腺癌绝经后。
因为辉瑞哌柏西利有明显的先发优势,所以曾经没有什么不同。在接下来的几年里,辉瑞继续扩大哌柏西利的适应症,比如2019年增加了芳香化酶抑制剂HR 、HER2-初始内分泌治疗男性乳腺癌患者。
?诺华瑞波西利(Kisqali():全球第二款CDK4/6抑制剂
2017年3月,诺华瑞波西利FDA与芳香化酶抑制剂联合治疗批准上市HR 、HER2-乳腺癌患者。
诺华瑞波西利于2021年10月22日在中国申报上市,目前尚未获批。
?阿贝西利(Verzenio):国内第二款CDK4/6抑制剂
2017年9月,阿贝西利由礼来研发FDA批准上市。
阿贝西利于2020年12月获得NMPA经批准,适应症与芳香酶抑制剂联合使用ER 、HER2-初始内分泌治疗的女性乳腺癌患者,或联合治疗晚期或转移性乳腺癌患者HR ,HER2-女性乳腺癌患者。这也是中国第二款获批上市的CDK4/6抑制剂。
?曲拉西利(Trilaciclib):适应症等CDK抑制剂4/6不同
曲拉西利由G1 Therapeutics研发是世界上第一款旨在改善癌症患者化疗预后的创新产品。它于2021年2月13日在美国上市。作为化疗期间保护骨髓和免疫系统功能的预防性给药产品,临床研究证明,其应用可以减少化疗期间小细胞肺癌患者骨髓抑制引起的副作用和并发症,具有骨髓保护作用FDA优先审查资格和突破性疗法认定。
2020年8月,先声药业与G1Therapeutics达成授权协议,首付1400万美元,最多11.获得56亿美元的里程碑费用Trilaciclib独家开发和商业化在大中华症的权利。
2021年11月,先声药业向NMPA提交骨髓保护创新药物曲拉西利上市许可申请(NDA)并接受。
?恒瑞达尔西利:第一个国产的CDK4/6抑制剂
2021年12月31日,恒瑞药研发的达尔西利获批上市,适应症为联合氟维司群用于激素受体(HR)人表皮生长因子受体2(HER2)经内分泌治疗后阴性复发或转移性乳腺癌的治疗。
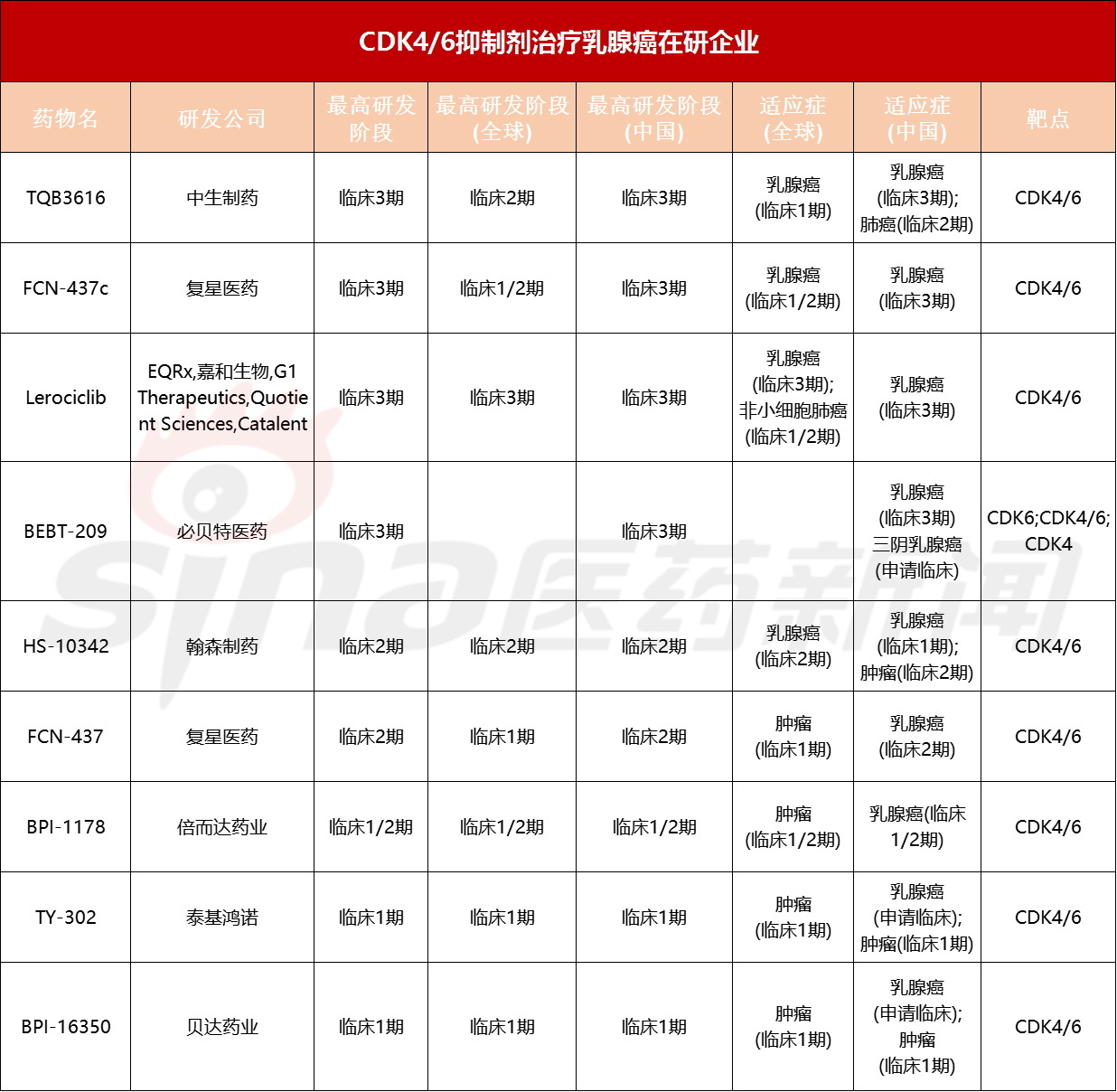
除了已经批准上市的5款车型外,国内对于CDK4/6抑制剂的开发热度相当高,很多企业都投入研发。CDK4/6抑制剂抗乳腺癌治疗市场正于硝烟状态,竞争日趋激烈。据中康科技报道,-FIC Intelligence显示,上海汉森、贝达药业、广州必贝特、复星药业等10家在研企业。
CDK4/6抑制剂掀起江湖混战
礼来成为辉瑞最大的竞争对手,其次是国内竞争对手
随着越来越多的制药企业进入该局CDK4/6抑制剂赛道,市场竞争格局悄然改变。
作为全球首款CDK4/6抑制剂,辉瑞哌柏西利也面临着专利悬崖的到来,没有抓住医疗保险的机会,销售面临下滑,众多仿制药眈眈等诸多威胁,如何搅动CDK4/6治疗乳腺癌的抑制剂市场格局如何?
?增长速度放缓!2022年,辉瑞哌柏西利Q销售额在美国下降了5%
巨大的市场,辉瑞哌柏西利,正逐渐被侵蚀。
起初,由于辉瑞哌柏西利在国内外具有明显的先发优势,它一度处于领先地位。然而,诺华瑞波西利和礼来阿贝西利相继脱颖而出,近两年销售额快速增长,辉瑞哌柏西利的市场份额逐渐受到挤压。
根据辉瑞年度财务报告,2018-2021年,哌柏西利分别实现业绩收入41.18亿美元、49.61亿美元、53.92亿美元,54亿美元,.3亿美元,增速逐渐放缓。
相比较而言,礼来阿贝西利虽然晚于辉瑞哌柏西利出世两年多,但销量却突飞猛进。根据财务报告,2019年至2021年,阿贝西利的销售业绩分别为5.8亿美元、9.13亿美元、13.5亿美元。虽然与50亿美元以上的哌柏西利市场规模还有很大差距,但增长速度惊人。其中,2020年增速高达57%,超过诺华的瑞波西利,成为辉瑞哌柏西利最强大的竞争对手。
IQVIA 最近的数据显示,哌柏西利的份额正在下降,尽管总体上保持领先地位。相比之下,诺华Kisqali 和礼来Verzenio但势头强劲。目前,辉瑞哌柏西利的销售额大幅下降。今年第一季度,哌柏西利在美国的销售额下降了5%。在这方面,辉瑞将其归因于更多患者通过患者援助计划获得药物。
?礼来阿贝西利后来居上,率先纳入医保
在国内市场,由于诺华瑞波西利尚未在中国获得批准,因此辉瑞哌柏西利的国内主要竞争对手仍为礼来阿贝西利。
值得注意的是,虽然辉瑞哌柏西利在国内外率先上市,但目前还没有被列入国家医疗保险目录。然而,李来阿贝西利后来居上,成功被列入2021年国家医疗保险目录,成为第一个也是唯一一个被列入医疗保险的CDK4/6抑制剂。
阿贝西利率先进入医疗保险。在政策的支持下,阿贝西利有望享受药品进入医院的红利和新增患者数量的增加,并迅速开拓市场。凭借价格优势,它迫使辉瑞诺贝利拥有市场份额。
据悉,阿贝西利进入医保后的价格分别为:1190元/箱(150)mg)、872.48元/盒(100 mg)、513.24元/盒(50 mg)。在医疗保险报销前,根据不同的规格,阿贝西利的月治疗费用在2053-4760元左右,自1月1日新医疗保险报销落地以来,月治疗费用仅为616-1428元,降幅为70%。
?辉瑞诺伯利适应症扩展
在这种情况下,辉瑞哌柏西利适应症的扩展并不顺利。2020年,他接受了内分泌疗法的治疗HR /HER2-早期乳腺癌III临床失败。
然而,2022年1月5日,礼来阿贝西利新适应症获得NMPA批准上市:激素受体治疗(他莫昔芬或芳香化酶抑制剂)联合内分泌治疗(HR) 2(HER2)阴性,淋巴结阳性,复发风险高Ki-67≥20% 成人早期乳腺癌患者的辅助治疗。
而在2022ASCO会议最新发布的三期PALOMA-试验的最终总生存期(OS)分析数据也显示失败:与来曲唑相比,安慰剂来曲唑CDK4/6抑制剂Ibrance(palbociclib,来曲唑一线治疗未能延长患者生命。
反复的临床失败可能会进一步影响哌柏西利的国内销售。一些分析师指出,尽管尽管Ibrance目前仍处于市场领先地位,但由于缺乏生存优势,这种药物可能会被越来越多的医生抛弃,逐渐失去市场份额。
?辉瑞哌柏西利专利悬崖正在逼近,大量仿制药企业虎视眈眈
此外,辉瑞哌柏西利专利悬崖也逐渐逼近,专利最早将于2023年到期。然而,仿制药的进入可能会给予CDK4/6赛道带来巨大变数。面对低价仿制药的冲击,辉瑞哌柏西利可能会陷入更加被动的局面。
目前,中国有齐鲁制药、江苏豪森、江苏奥赛康、北京康立生、南京正大天晴、南京济群制药、南京海纳制药、山东罗欣、哈尔滨景泉制药、浙江海正等十多家企业。
其中,获得第一仿制药的企业是齐鲁制药,其哌柏西利仿制药于2020年12月获批上市,正在摩拳擦掌,期待哌柏西利专利悬崖的到来。目前国内还没有企业对其他药品进行仿制跟进。
