临床研究失败TOP10
文丨树叶
基于医药魔方网站行业快讯板块,NextPharma2022年2月的数据库、公开信息和临床研究月报筛选出10项未达到主要终点的临床研究,供您参考。
去年12月,帕博利珠单抗和仑伐替尼的可乐组合继去年12月之后LAEP-007研究失败后,一线晚期尿路上皮癌的治疗再次失败,其他包括度普利尤单抗治疗慢性自发性荨麻疹III期间研究失败,阿维鲁单抗两项临床研究失败,RNA治疗受挫等。
1. 帕博利珠单抗联合仑伐替尼一线治疗尿路上皮癌III期研究
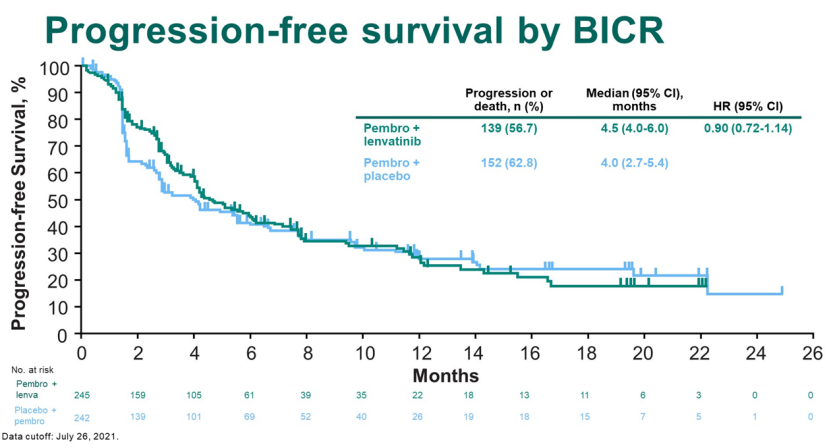
2022年2月,2022年泌尿生殖系统癌症研讨会(ASCO GU22)公布帕博利珠单抗联合仑伐替尼作为不适合铂化疗的晚期尿路上皮癌患者的临床治疗III期研究(LEAP-011)最终数据。
结果表明,与帕博利珠单抗相比,帕博利珠单抗联合仑伐替尼没有显著改善。(PFS)和总生存期(OS),研究未达到主要终点。
来源:ASCO GU22

来源:ASCO GU22
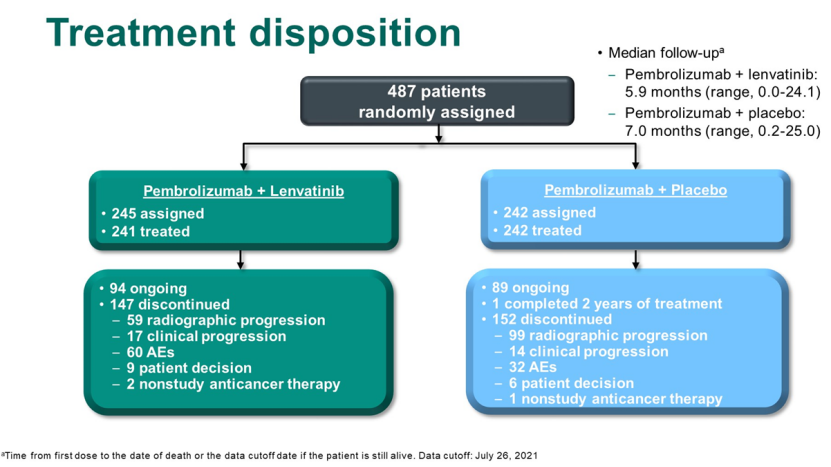
LEAP-011研究是一项双盲、随机对照研究,计划招募694名患者,设计530例PFS事件后进行OS和PFS中期分析,或在第一个病人被随机分组后大约24个月。然而,独立的数据监控委员会(每3个月审查一次安全数据)是基于 OS、PFS 及整体缓解率 (ORR) 数据确定的帕博利珠单抗联合仑伐替尼的风险比决定提前停止试验患者的招募。最终,487名患者入组,其中245人入组仑伐替尼,242人入组安慰剂。
来源:ASCO GU22
在安全性方面,帕博利珠单抗联合仑伐替尼显示较高比例的不良事件发生率和严重不良事件。值得注意的是,仑伐替尼组19.患者9% TRAE停药,安慰剂组为9.1%。此外,仑伐替尼还导致了更明显的相关不良事件发生率。
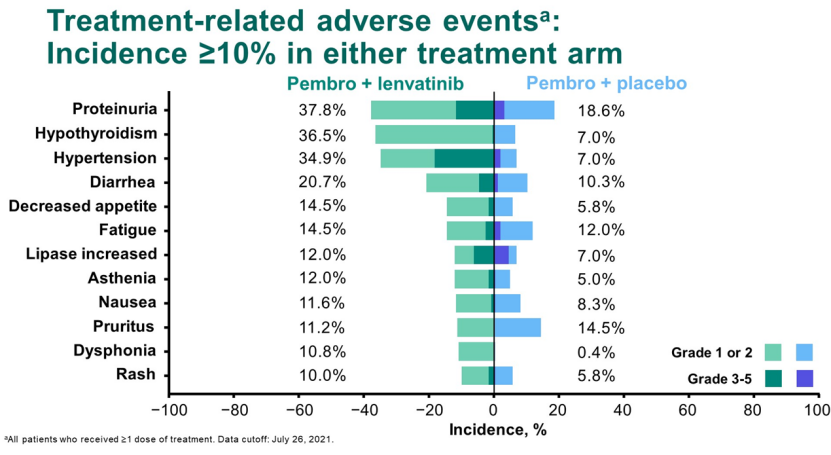
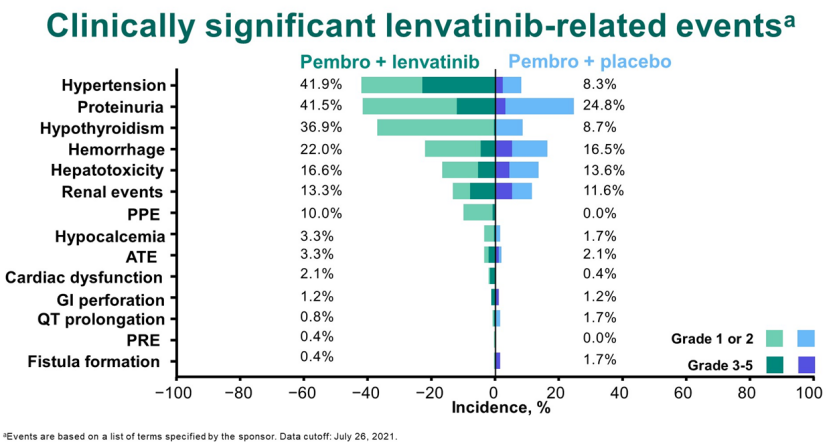
帕博利珠单抗联合仑伐替尼已在美国、欧盟和日本获得肾细胞癌和子宫内膜癌的批准。2021年,默沙东从仑伐替尼获得超过7亿美元的销售份额,这在一定程度上证明了帕博利珠单抗联合仑伐替尼在癌症治疗中的潜力。然而,去年12月,帕博利珠单抗联合仑伐替尼与帕博利珠单抗头对头III期临床研究(LAEP-007)结果正式披露,联合治疗并未显示肺癌的明显好处。
除了伦伐替尼,帕博利珠单抗与奥拉帕利的合作也为默沙东在2021年带来了近10亿美元的份额收入;然而,对于阿斯利康本身来说,奥拉帕利并没有为自己服务PD-L药物英飞凡(度伐利尤单抗)增加了效益。ASCO GU在22届会议上,度伐利尤单抗联合奥拉帕利的临床实践Ⅱ期研究 (BAYOU,NCT03459846)显示,与单独使用的转移性尿路上皮癌患者相比,联合治疗没有显著延长以前未治疗且不适合铂治疗的转移性尿路上皮癌患者PFS,错过主要终点。
此外,阿维鲁单抗对顺铂不耐受,PD-L1 阳性晚期尿路上皮癌患者临床Ⅱ期研究中(ARIES),未达到改善患者1 年总生存期的研究目的。阿替利珠单抗在阿替利珠单抗中。ASCO GU22会上也公布了治疗晚期阴茎鳞状细胞癌患者的不利消息Ⅱ期PERICLES试验也未达到其一年无进展生存期的主要终点。
2.慢性自发性荨麻疹慢性自发性荨麻疹III期研究
2月18日,赛诺菲/再生元宣布Dupixent (度普利特单抗)omalizumab(奥马珠单抗)慢性自发性荨麻疹(CSU)患者III期CUPID STUDY B研究没有基于预先指定的疗效而终止。虽然观察到了减少瘙痒和荨麻疹的积极数值趋势,但中期分析的结果表明,该研究对主要终点没有统计意义。
LIBERTY-CUPID重点项目于2020年启动,采取加速直接进入三期的策略。LIBERTY-CUPID临床计划的Study B 评估83岁的度普利尤单抗,12至80岁的度普利尤单抗CSU患者的疗效和安全性。虽然这些患者接受了标准治疗,但仍有症状,对奥马珠单抗不耐受或反应不充分。在为期24周的治疗中,患者每两周接受度普利尤单抗 抗组胺药或安慰剂 抗组胺药。
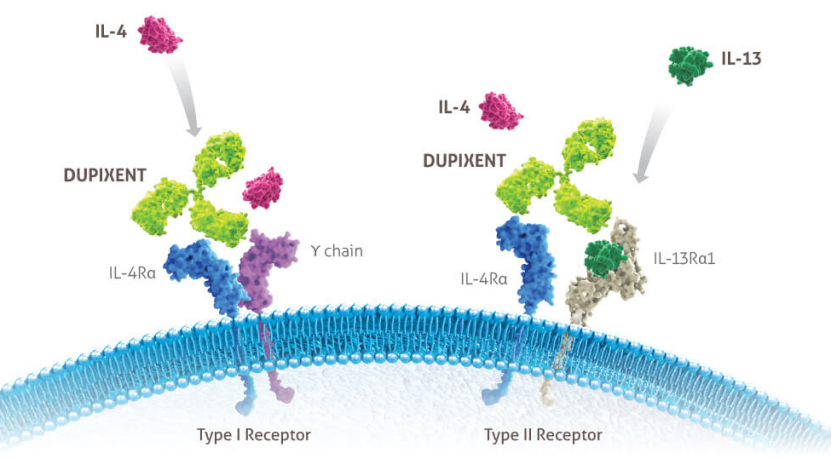
结合度普利特单抗IL-4Rα阻断白细胞介素 4 (IL- 13 (IL-13) 通路信号传输。IL-4 和 IL-13 是2型炎症的关键和核心驱动因素,伴有特应性皮炎、哮喘和慢性鼻窦炎的息肉 (CRSwNP) 起主要作用。目前,度普利尤单抗已被美国、欧洲、中国、日本和世界其他国家批准用于治疗特定中度至重度特应性皮炎的特定患者,以及不同年龄段的一些哮喘或慢性鼻子-鼻窦炎伴鼻息肉(CRSwNP)患者。
自发性荨麻疹(CSU)它是一种慢性炎症性皮肤病,其特征是皮肤上突然出现荨麻疹和/或深层皮下肿胀。虽然有标准的护理治疗,但患有 CSU 人们经常出现持续瘙痒或灼烧等症状,显著影响生活质量。肿胀通常发生在面部、手和脚上,但也会影响喉咙和上呼吸道。这个临床计划Study A与单独使用抗组胺药相比,评估了度普利尤单抗作为标准疗法药的附加疗法在138名6岁以上。CSU病人的疗效和安全。
赛诺菲和再生元正在迅速推进广泛的临床开发计划,以评估Dupixent在明显不满足需求的疾病和与2型炎症相关的疾病中发挥作用。这两家公司最近宣布,两家公司最近宣布,Dupixent嗜酸细胞性食管炎 (EoE) 和结节性瘙痒 (PN) 方面的III期间的积极结果预计今年晚些时候还会在孩子身上EoE、慢性诱导性荨麻疹(CindU) 和手足特应性皮炎取得了更多的成果。
3. 他拉唑帕尼联合阿维鲁单抗治疗透明细胞肾细胞癌 II 期研究
ASCO GU在22次会议上,研究人员还发起了晚期透明细胞肾细胞癌的评估(RCC) 队列中联合他拉唑帕尼和阿维鲁单抗的单中心II期间测试数据。结果表明,在结果中,在VHL缺陷型TKI/ICB难治性RCC在队列中,研究没有达到预定继续入组的疗效阈值,结果不支持该组的进一步研究。
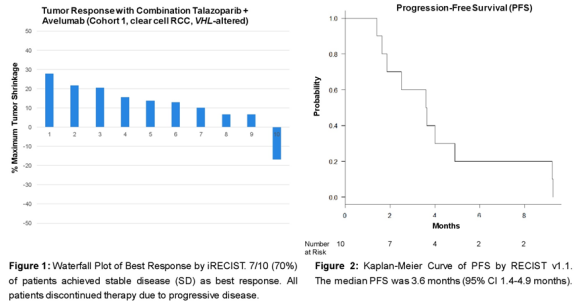
VHL可能会导致失活DNA损伤反应路径损伤和复制压力增加,从而增加透明细胞肾细胞癌的基因组不稳定性。这项研究主要分为两个队列,1(VHL RCC),病人之前必须接受 VEGFR TKI 和ICB治疗,之前最多接受过三线治疗。主要终点是基于。iRECIST评估的客观缓解率包括无进展生存期、安全性和耐受性。
这是PARPi和ICB晚期透明细胞联合治疗RCC第一次临床研究。MSK-IMPACT组织NGS 测序检测到所有患者的表现VHL3/10 (30%) 患者缺失DDR体细胞或种系在特异性基因中同时发生变化。没有客观肿瘤反应,疾病控制率为60%(6/10),疾病稳定性是患者的最佳反应。所有病人都有疾病进展,中位,中位PFS为3.6个月(95% CI 1.4-4.9)。
4. KSI-301治疗年龄相关性黄斑变性IIb/III期研究
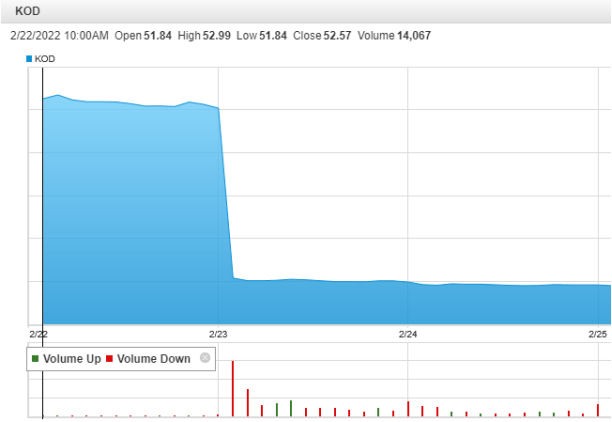
2月23日,Kodiak公司宣布,KSI-301用于治疗新生血管性(湿性)年龄相关性黄斑变性(wAMD)患者的IIb/III期间试验未能达到主要疗效终点。受此消息影响,公司股价大幅下跌80%。
KSI-301是一种基于Kodiak抗体-生物聚合物偶联物(Antibody Biopolymer Conjugate ,ABC)抗平台开发VEGF该疗法用于提高药物的稳定性和眼睛的停留时间。该试验入组559名受试者,随机分为两组:KSI-301 5mg灵活的长间隔方案(Q12W/Q16W/Q20W)和阿柏西普(aflibercept)2mg固定短间隔方案(Q8W)。所有受试者在0周、4周和8周内给予三个月的负荷剂量。之后,阿柏西普集团的受试者每两个月接受一次治疗;负荷剂量治疗后第20周开始评估KSI-根据预定的疾病活动标准,301受试者每3个月、4个月或5个月接受一次疾病活动KSI-301治疗。
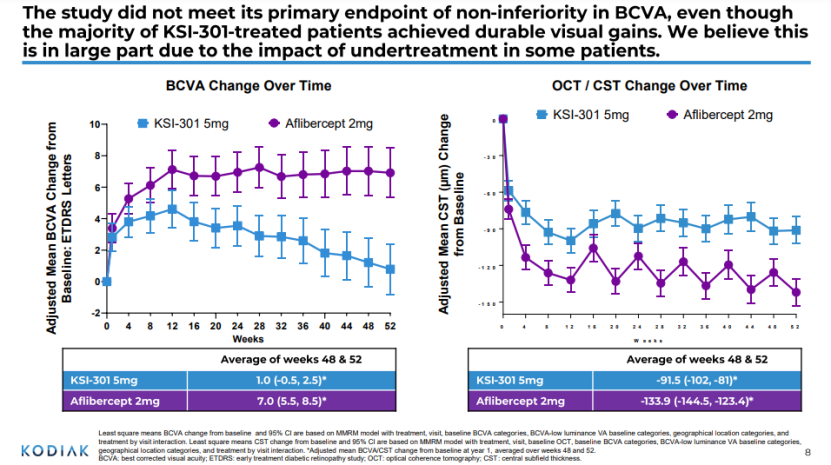
结果表明,与阿柏西普每8周给药一次相比,KSI-301组患者的视力改善不如阿柏西普好。目前,阿柏西普普目前还没有阿柏西普好。(VEGFR-Fc每2个月给药一次(前3个月每月一次),是的wAMD标准疗法。诺华开发的。Beovu(brolucizumab)是单链抗体片段(scFv),它可以实现更高的摩尔剂量,是第一种治疗方法wAMD每三个月只需注射一次anti-VEGF疗法;罗氏的Faricimab今年1月28日刚刚获得FDA批准是治疗中第一个批准DME和wAMD每四个月给药一次。
5. SNG001治疗新冠肺炎III期研究
2月21日,Synairgen公司宣布,SNG001临床治疗新冠肺炎住院患者III期SPRINTER研究未达到其主要或关键次要疗效的终点。受此消息影响,Synairgen公司股价下跌84%。
SNG001是一种天然的广谱抗病毒蛋白干扰素β,可直接吸入肺部,刺激机体免疫反应,防止新冠肺炎患者因需要氧气而缺乏呼吸机而恶化。SPRINTER临床上是随机、双盲、安慰剂对照的III定期研究旨在评估SNG001治疗中度新冠肺炎住院患者的有效性和安全性。共有623名受试者被随机分配和接受。SNG001 (n=309)和安慰剂(n=314)治疗。
结果显示,接受SNG001患者不太可能恢复到无限活动状态,出院率也不高于安慰剂患者。研究人员表示,标准护理的演变87%的患者在基线接受了系统性皮质类固醇治疗)可能是未能达到主要终点的部分原因。在次要终点方面,使用SNG与使用安慰剂的患者相比,在35天内进展为严重疾病或死亡的相对风险分别降低27%和36%。
不过,Synairgen公司没有放弃SNG001,仍在开发用于居家治疗的临床研究,已计划开展临床治疗Ⅲ期试验。辉瑞在Paxlovid成功上市后,片剂已停止作用于SARS-CoV-2病毒3CLpro蛋白酶静脉注射药物PF-07304814临床研究。PF-07304814也曾被纳入NIH 赞助的 ACTIV-在3 研究中,该研究用于住院 COVID-19 患者的各种药物,包括辉瑞、礼来、葛兰素史克、诺华等公司的新冠候选药物。
6. Sepofarsen治疗Leber先天性黑蒙症10型Ⅱ/Ⅲ期研究
2月11日,RNA疗法公司ProQR Therapeutics宣布Sepofarsen用于治疗CEP290介导的Leber先天性黑蒙症10 (LCA10) 的关键Ⅱ/Ⅲ期 Illuminate第12个月未达到最佳矫正视力 (BCVA) 的主要终点。受此消息影响,ProQR股价大跌74%,目前市值不足1亿美元。
Sepofarsen(QR-110)是一种研究性研究RNA疗法,旨在恢复原因CEP290基因突变 (p.Cys998X) 导致的Leber先天性黑蒙症10眼视力。这一突变导致了眼睛视力。mRNA和非功能性CEP290蛋白异常剪接,Sepofarsen旨在恢复正常(野生)CEP290 mRNA 并产生功能性CEP290蛋白。Sepofarsen通过眼部玻璃注射给药,在美国和欧盟获得孤儿药指定,并获得 FDA指定快速通道和罕见儿科疾病。

LCA它是儿童遗传病引起失明的最常见原因,由一组疾病组成,其中包括一组疾病。LCA10 是最常见、最严重的形式之一。LCA10由EP290基因突变引起,其中c.2991 1655A
