四种创新药在六月有望被使用FDA批准 | Bilingual
6月份,预计FDA以下四种药是否批准以下四种药物。
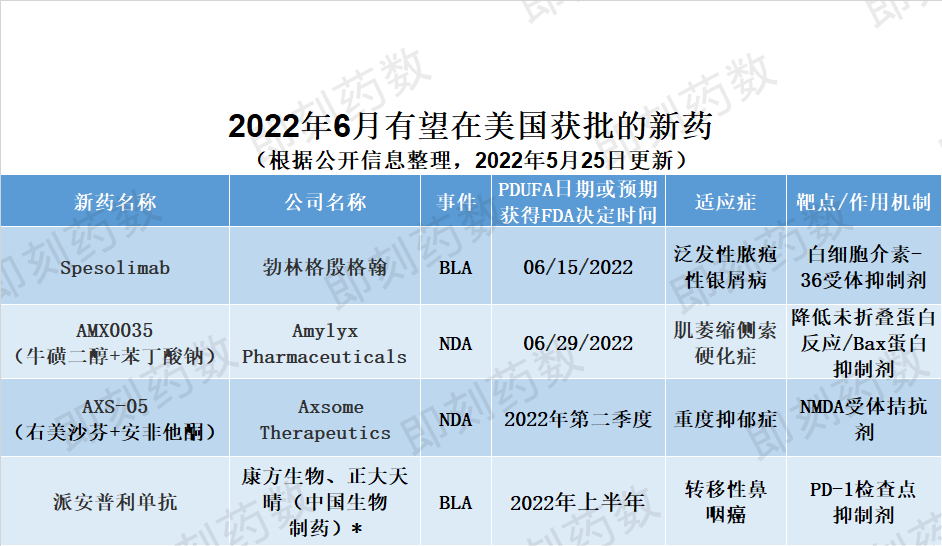
▲预计6月份在美国获批的新药(姚明康德内容团队制图,点击可见大图)
药物名称:spesolimab
公司名称:勃林格殷格翰(Boehringer Ingelheim)
适应症:泛发性脓疱性银屑病(GPP)
勃林格殷格翰的spesolimab它是一种可以阻断白细胞介素-36受体的人源性选择性抗体(IL-36R)正在寻求激活FDA用于治疗泛发性脓疱性银屑病的批准(GPP)发作。在为期12周的两期临床试验中观察到,治疗仅一周后,GPP快速清除成年患者的脓疱。FDA2021年12月接受生物制品许可申请(BLA)并授予其优先评审资格,PDUFA日期为6月15日。这种药物在美国也有资格服用孤儿药和突破性疗法。如果获得批准,spesolimab将成为FDA批准的第一种治疗方法是一种罕见的皮肤病,可能危及生命,存在紧急情况,不能满足需求。
药物名称:AMX0035(牛磺二醇)
公司名称:Amylyx Pharmaceuticals
适应症:肌萎缩侧索硬化症(ALS)
Amylyx公司的AMX0035是治疗肌萎缩侧索硬化症的专有口服固定剂量组合(ALS)。AMX苯丁酸钠是两种药物(sodium phenylbutrate)牛磺酸二醇(taurursodiol)复合制剂。苯丁酸钠是一种小分子蛋白伴侣,可以减少无折叠蛋白反应,减少无折叠蛋白反应(UPC),防止UPC导致细胞死亡。牛磺酸二醇是一种Bax蛋白质抑制剂。它们可以改善线粒体和内质网的健康状况,从而延缓神经细胞的死亡。FDA提交新药申请(NDA)基于一个项目,组织了137个案例ALS从患者第二阶段临床试验中获得的积极数据。试验达到其主要疗效结束,即根据修订的结果ALS在6个月的随机化阶段结束时,接受功能评估量表AMX0035治疗的ALS患者运动功能下降明显减慢。这种治疗的方法NDA于2021年12月被FDA接受并取得优先审查资格,PDUFA2022年6月29日的目标日期。
最近发布的数据分析进一步表明,早期使用AMX0035可以减少死亡、气管切开术或永久性辅助通气ALS患者的发病率。该公司正在进行三期临床试验,并于2022年3月在美国进行了三期临床试验,以防不能参加三期临床试验ALS患者启动了AMX扩展使用项目0035(Expanded Access Program)。如果获得批准,AMX0035将提供一种新的治疗选择,可以帮助延迟ALS机械通气等病人的医疗干预。
药物名称:AXS-05(右美沙芬)
公司名称:Axsome Therapeutics
重度抑郁症(MDD)
Axsome的AXS-05是治疗严重抑郁症的专有口服药物组合(MDD)。它由右美沙芬(dextromethorphan)和安非他酮(bupropion)构成,并使用Axsome公司的代谢抑制技术。右美沙芬是一种非竞争性的技术NMDA受体拮抗剂,它也是sigma-1.受体激动剂、烟碱乙酰胆碱受体拮抗剂、5-羟色胺和去甲肾上腺素转移蛋白的抑制剂。安非他酮可以提高右美沙芬的生物利用率。同时,它也是去甲肾上腺素和多巴胺的再摄入抑制剂,也是烟碱乙酰胆碱受体的拮抗剂。该公司于2021年提交了该疗法NDA,并获得了FDA优先审评资格。NDA中重度得到两项MDD支持患者中的随机双盲对照临床试验(3期临床试验)GEMINI,2期临床试验ASCEND)。其中,327中重度MDD参与成成年病人GEMINI试验中,与安慰剂组相比,AXS-05快速而显著地改善了患者的抑郁症状,达到了试验的主要目的。
在Axsome最近和FDA上市后达成协议后,公司预计FDA2022年第二季度NDA做出回复。AXS-05也用于治疗阿尔茨海默病(AD)躁动症状(agitation)突破性疗法的认定。它目前正在进行中。AD临床临床开发和戒烟两期临床开发阶段。如果获得批准,药物的组合将是治疗MDD以及其他潜在的中枢神经系统疾病带来新的治疗方法。
药品名称:派安普利单抗单抗单抗单抗
公司名称:康方生物、正大天晴(中国生物制药)
适应症:转移性鼻咽癌
康方生物与中国生物制药子公司正大天晴联合开发的人源化抗性抗性PD-单克隆抗体安普利单抗体抗体抗体抗体抗体抗体抗体单抗体抗体抗体抗体抗体抗体单抗体抗体抗体抗体抗体单抗体抗体抗体抗体抗体抗体抗体单抗体抗体抗体抗体抗单抗体抗体抗体抗体抗体抗单抗体抗体抗体抗体抗体抗体抗单抗体抗体抗体抗体抗体抗体单抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体单抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体单抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体抗体(penpulimab)正在等待FDA转移性鼻咽癌转移性鼻咽癌。BLA2021年5月提交FDA,并使用实时肿瘤学评估(RTOR)审查试点项目。该项目旨在加快药物批准过程。在美国,基于预期的临床数据,帕普利单抗已经获得了转移性鼻咽癌三线治疗的突破性治疗和快速通道资格,以及治疗鼻咽癌的孤儿药物。因为它是独特的PD-结合表位,这种药物可以获得更好的临床疗效。
