25年来首款!FDA批准银屑病外用新药上市
今日,Dermavant Sciences公司宣布,美国FDA已批准Vtama(1% tapinarof,每日一次)乳膏用于外部治疗斑块状银屑病成人患者。根据新闻稿,这项批准包括所有银屑病患者,无论严重程度如何,并且标签上对持续时间和身体部位没有限制。这是美国25年来首个批准治疗银屑病的外部新分子实体,代表了一种创新的非类固醇外部治疗类型。值得一提的是,这种创新疗法于2019年首次在中国获得批准,名为本维莫德(benvitimod)乳膏。
牛皮癣,又称牛皮癣,是一种常见的慢性、自身免疫性炎症性皮肤病。世界上大约有1.中国有25亿银屑病患者,约800万人。对于症状严重的患者,银屑病对其生活质量有重大影响。目前,糖皮质激素和维生素是银屑病的首选D衍生物,糖皮质激素虽然见效快,但是停药后病情容易反复,而且长期使用有安全风险,所以通常不能连续使用。
Tapinarof是一种“first-in-class芳香烃受体调节剂。它是一种天然化合物,从土壤线虫的共生细菌代谢物中分离出来。它最初是从土壤线虫的共生细菌代谢物中分离出来的。Welichem Biotech公司开发。此后,该药物在大中华区以外的研发权益多次转手,2018年由Dermavant获得。Tapinarof作为一种分子量只有254的非激素性小分子药物Da,皮肤渗透性好。
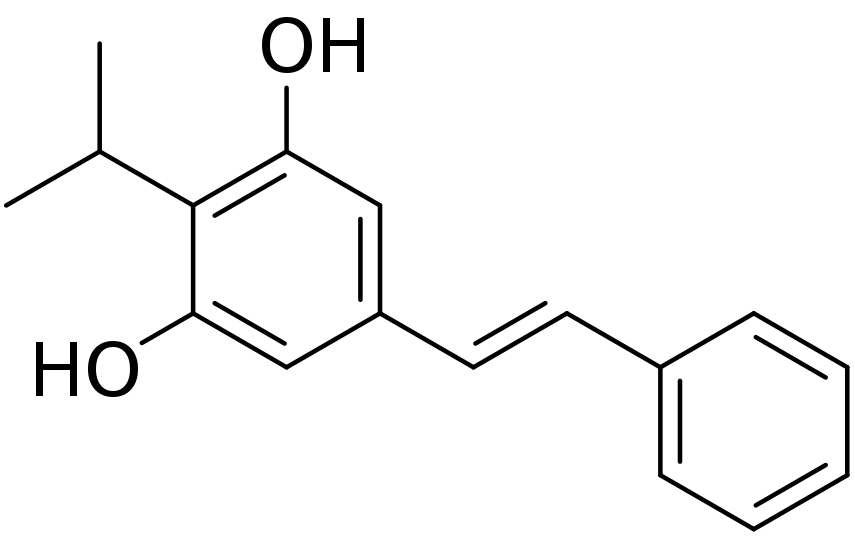
▲Tapinarof分子结构类型(图片来源:Edgar181,Public domain,via Wikimedia Commons)
芳香烃受体在调节自身免疫反应方面起着重要作用。Tapinarof通过调节芳香烃受体的功能,可以抑制芳香烃受体的功能IL-17炎症反应介导。IL-17信号通路可以说是治疗银屑病的明星通路IL-17银屑病疗法包括诺华(Novartis)公司开发的Cosentyx(可善挺),优时比(UCB)公司开发的Bimzelx,还有礼来公司开发的Taltz。
在两个关键的三期临床试验中,tapinarof达到所有主要和次要终点,称为PSOARING在临床试验中,36%的临床试验接受tapinarof治疗的患者符合去除或接近去除皮肤症状的标准,对照组值为6%。在另一个三期临床试验中,这两个值分别为40%和6%(p
