Mirati:向EMA提交adagrasib治疗携带KRAS G12C突变NSCLC患者的MAA
2022年5月19日,Mirati Therapeutics(简称“Mirati)宣布已向欧洲药品管理局提交(EMA)提交营销授权申请(MAA),用于adagrasib治疗携带 KRAS G12C非小细胞肺癌突变(NSCLC)这些病人之前至少接受过一次全身治疗。这个项目MAA 2.KRYSTAL-1队列研究注册数据支持,评估adagrasib 600mg BID 提前免疫治疗和化疗后携带KRAS G12C晚期突变NSCLC病人的疗效。adagrasib新药申请 (NDA)美国食品和药品管理局正在接受(FDA)加速批准审查。

Adgrasib 是一种研究,选择性高,效果强KRAS G12C优化后,口服小分子抑制剂保持靶点抑制,因为 KRAS G12C 蛋白每24-48小时再生一次。这个属性是治疗KRAS G12C癌症突变非常重要。2022年1月,Mirati 在2022年ASCO-GI 上公布了adagrasib临床试验1/2KRYSTAL-1最新数据。

研究表明,截至2021年9月10日,Adagrasib10个可评估的伙伴KRAS G12C不可切除或转移性胰腺癌突变(PDAC)中度疾病控制率(DCR)达到100%,总缓解率(ORR)疾病稳定率为50%(5/10)(SD)50%(5/10)KRAS G12C在其他类型的突变性胃肠道肿瘤中,DCR达到了100%,ORR35%(6/17),SD65%(11/17)。
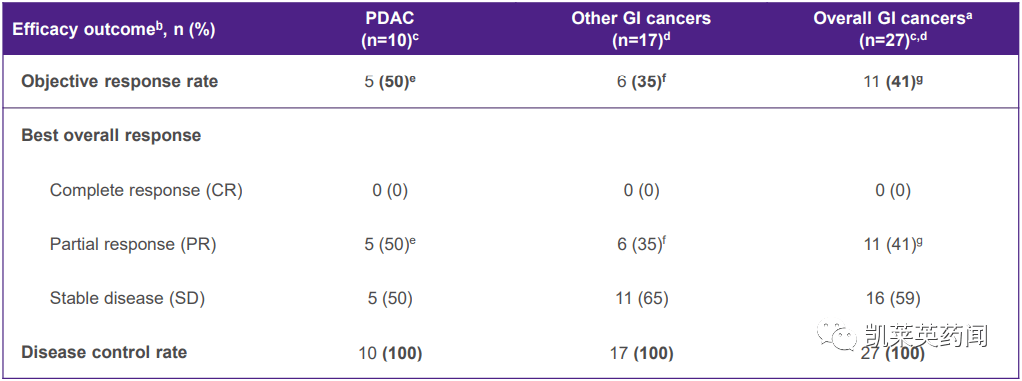
此外,PDAC中位缓解的持续时间(mTTR)为2.中位疾病控制持续8个月(mDOR)为6.6个月,中位无进展生存期(mPFS)为6.6个月。
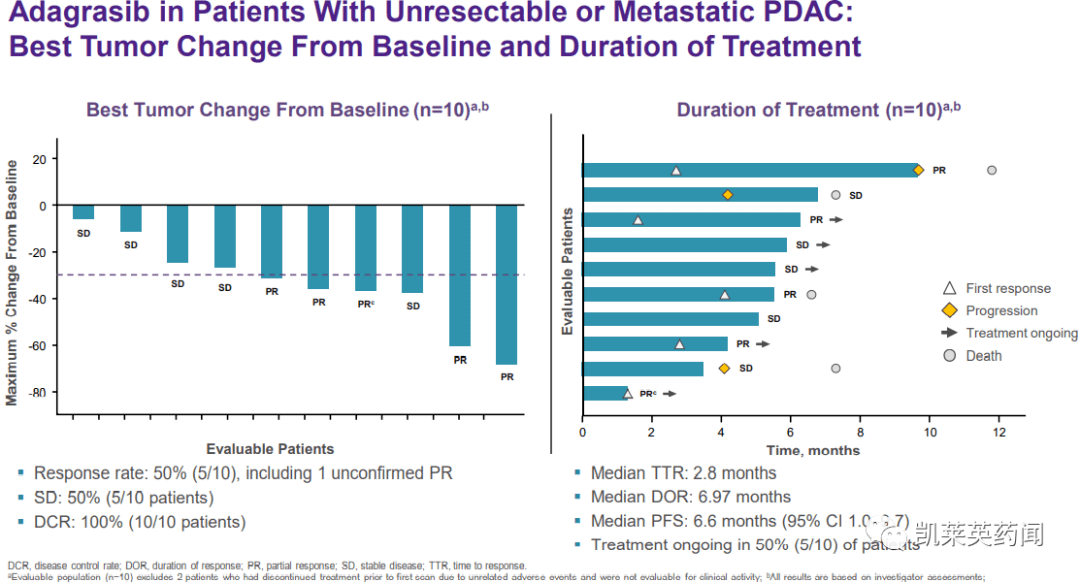
在其他胃肠道肿瘤中,mTTR为1.3个月,mDOR为7.85个月,mPFS为7.截至2021年9月10日,85个月仍有11名患者接受治疗。
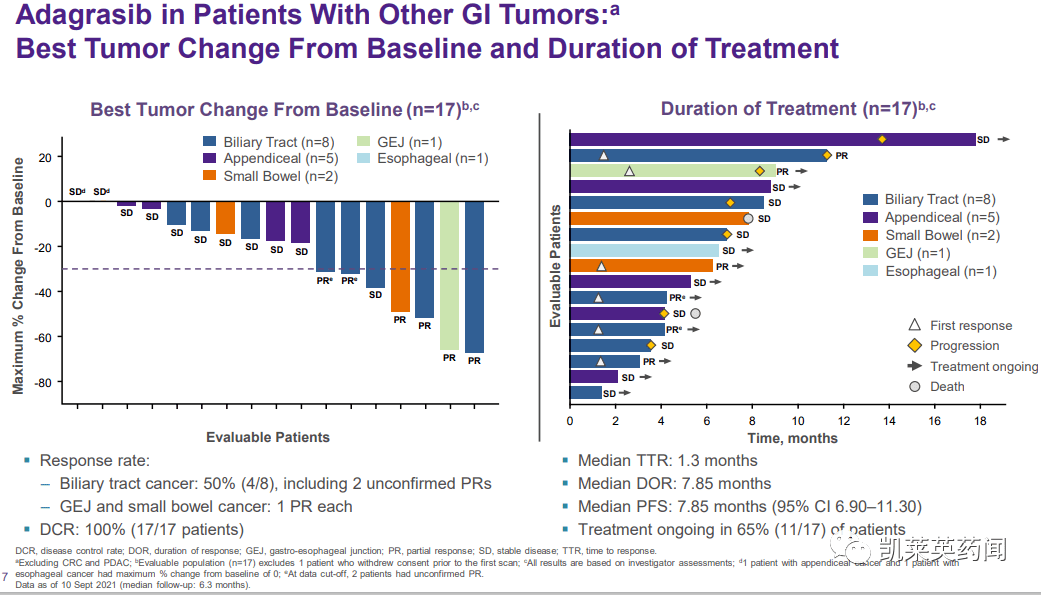
在所有42名受试者中,可以评估27名肠道肿瘤患者的临床活动,41%(11/27)的部分缓解(PRs),100%/27/27的疾病控制率。
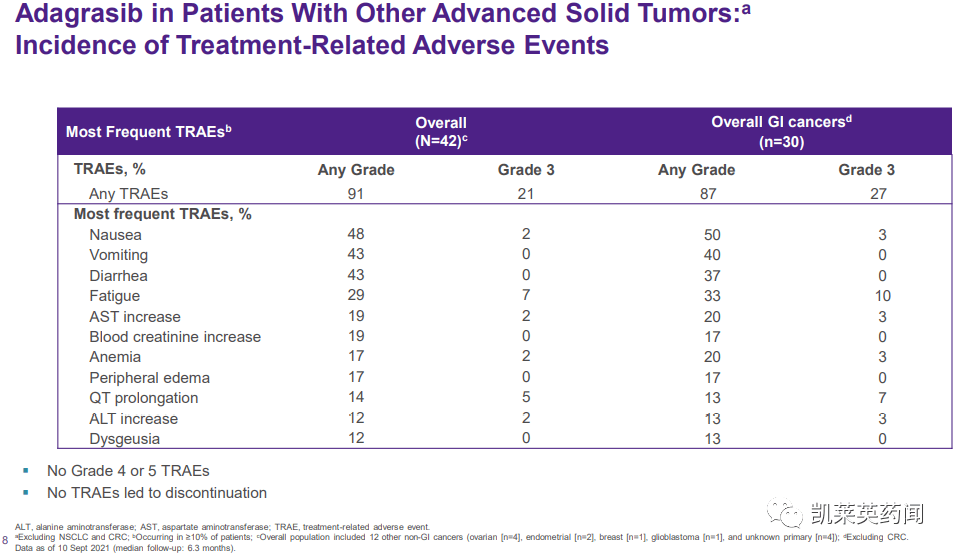
在不良反应方面,任何级别的不良事件都与治疗有关(TRAE)发病率为91%(38/42),最常见的是恶心(48%)、腹泻(43%)、呕吐(43%)和疲劳(29%)。TRAE。
“我们向 EMA 提交的申请是对的Mirati 是一个重要的里程碑。如果得到批准,我们将进一步扩大adagrasib 对欧盟 KRAS G12CMirati总统、创始人和研发负责人Charles Baum博士说,“KRAS G12C肺癌突变的治疗选择有限,这是我们朝着提供创新和差异化治疗的目标迈出的重要一步。我们期待着 EMA 合作,给更多的患者带来这种疗法。同时,我们也感谢患者和研究人员通过参与临床试验使我们的工作成为可能。
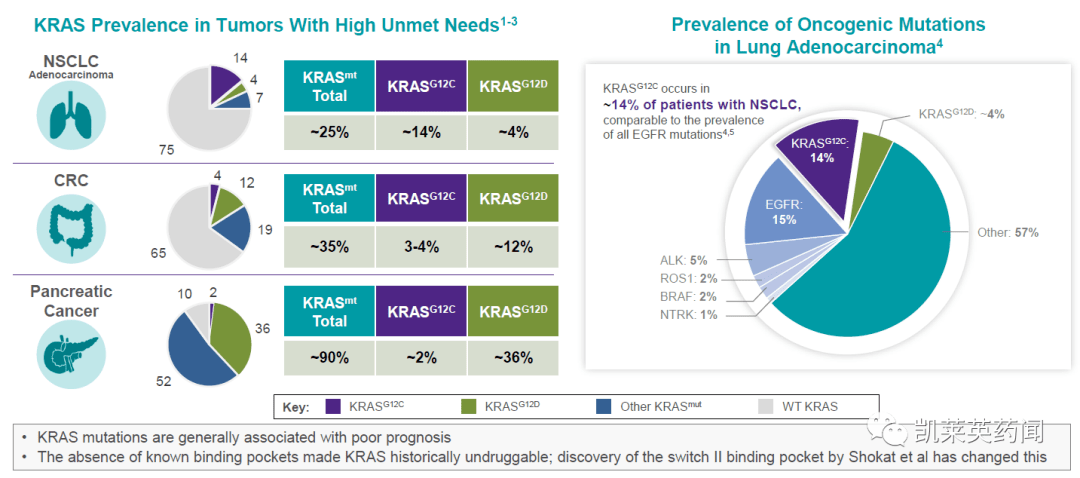
据统计,在吸烟者中,KRAS非小细胞肺癌突变型的最高比例约为35%,远远超过其他类型。
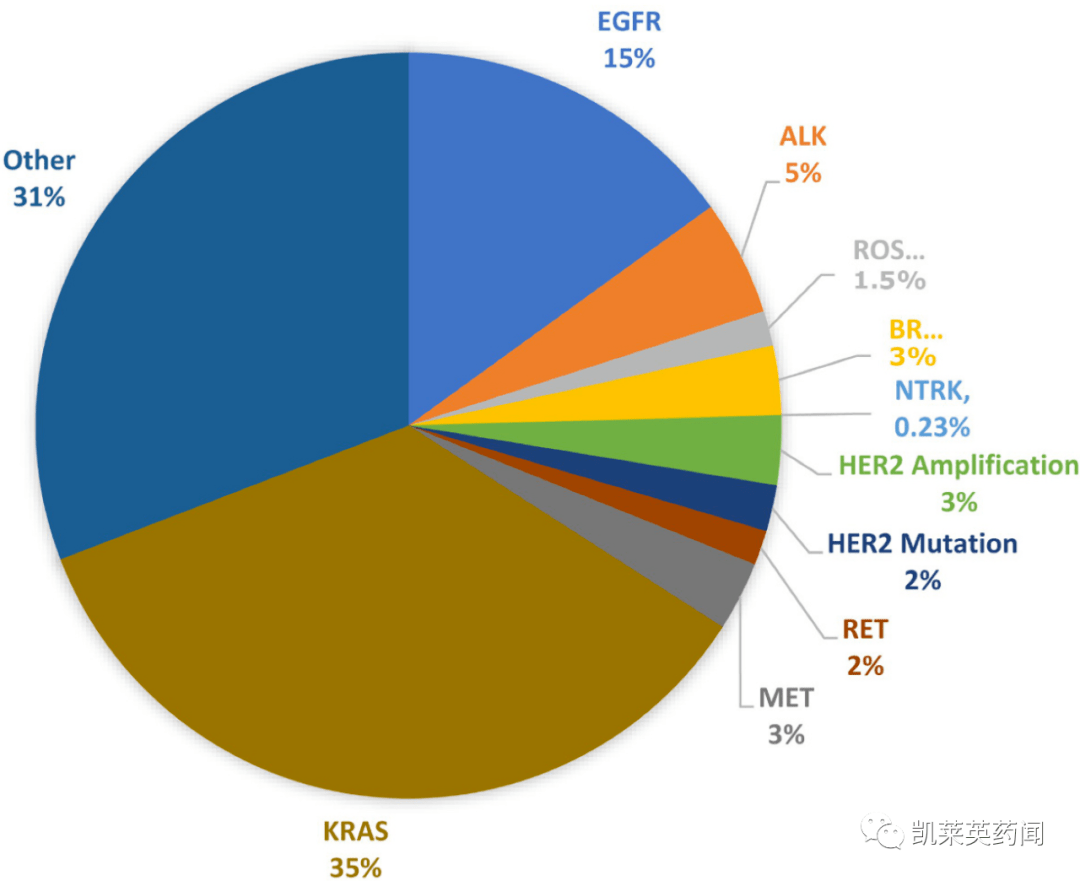
在所有人群中,肺腺癌KRAS突变的比例也远高于其他类型的突变。
2021年6月,再鼎医药预付6500万美元,总价300万美元.38亿美元获adagrasib引绍大中华区(中国大陆、香港、澳门、台湾省)的独家权益;2021年11月,再鼎医药已向中国国家食品药品监督管理局药品审评中心发送(CDE)提交的adagrasib临床试验申请。预计未来,adagrasib将在全球范围内获得批准,让更多患者受益!
