血腥赌局?手握重磅新冠口服药的君实生物活不好
新药研发九死一生,不亚于一场豪赌。
文 | Linan
PD-1中国获得了五项适应症。虽然出海计划因疫情而推迟,但总比其他国内创新药要好,需要国际临床数据证明,新冠肺炎口服药物VV116国内获批在即...在生物医学和抗疫药物的研发中,君实生物似乎很能抓住机遇,一个不落地稳步推进。
新药研发九死一生,不亚于一场豪赌。君实生物与时间博弈。
A
新药研发烧钱不止,近5年累计净利亏损43亿元
51月16日,君实生物提交2022年向特定对象发行A股票招股说明书,保荐机构为海通证券。同时,君实生物A股定增已被上交所受理。

君实生物拟发行股份不超过7000万股,募集资金总额(含发行费用)不超过7000万股39.801亿元(含本金额),扣除发行费用后募集资金总额净额用于创新药研发项目、上海骏实生物科技总部及研发基地项目。
君石生物承认,本次募集投资项目将有助于加快公司的临床研究工作,促进国内外相关产品的上市过程,加强公司临床前研究与临床研究的协调,在一定程度上缓解公司研发和运营资金的紧张局面。
君实生物成立于2012年,是一家致力于创新药物发现和开发、临床研发和全球商业化的创新驱动型生物制药公司。2015年,君实生物在新三板正式上市,2018年和2020年分别在港交所和科技创新板上市,这是第一个新三板H上市公司创板上市公司。
公司自成立以来,几乎每年都在亏损。2016年~2021年,君实生物归母净利润分别为-1.35亿元、-3.17亿元、-7.23亿元、-7.47亿元、-16.79亿元、-7.21仅这五年,君实生物就累积亏损43.22亿元。
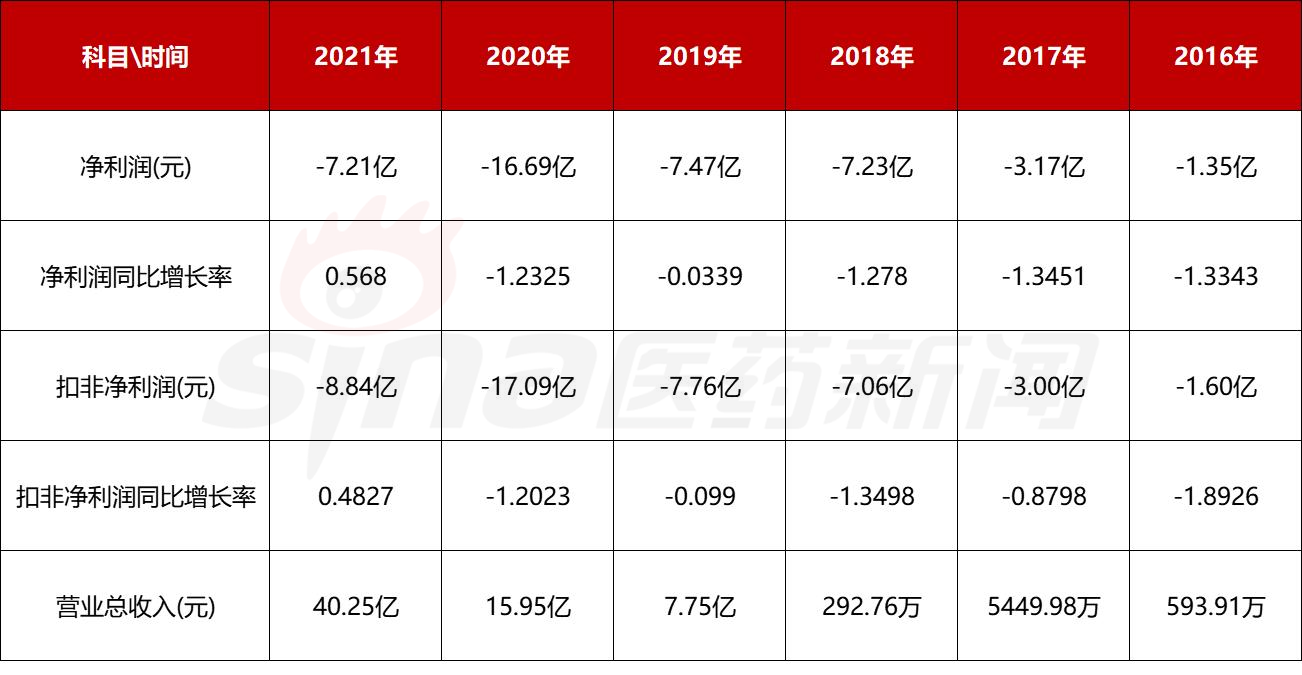
尽管2021年君实生物的亏损正在收窄,但与2018年、2019年相比,亏损仍在扩大。根据君实生物2022年第一季度报告,公司主6.3同比下降1亿元61.02%;归母净利润-39639.55万元,同比下降205.06%;扣除非净利润-42958.33万元,同比下降218.99%。
在本次募资说明书中,君实生物明确提到,截至2022年3月31日,君实生物累计未分配利润为-478,498.05万,公司尚未盈利,累计亏损较大。在未来一段时间内,公司将面临累未弥补亏损和持续亏损的潜在风险。
比如公司有很多R&D管道,很多在研项目进入II、III临床试验中,R&D费用支出连续几年较大,2019年、2020年、2021年和2022年一季度R&D费用金额分别为94,610.00万元、177,802.30万元、206,873.93万元及51,091.20万元。
同时,君实生物在临床前研究的早期阶段也保留了一些研究项目,未来仍需要继续大规模研发投资完成临床前研究、临床试验和新药准备产品管道研发业务,新药上市申请、新药市场推广也将带来高成本,可能导致进一步扩大损失,对日常经营、财务状况等方面产生不利影响。
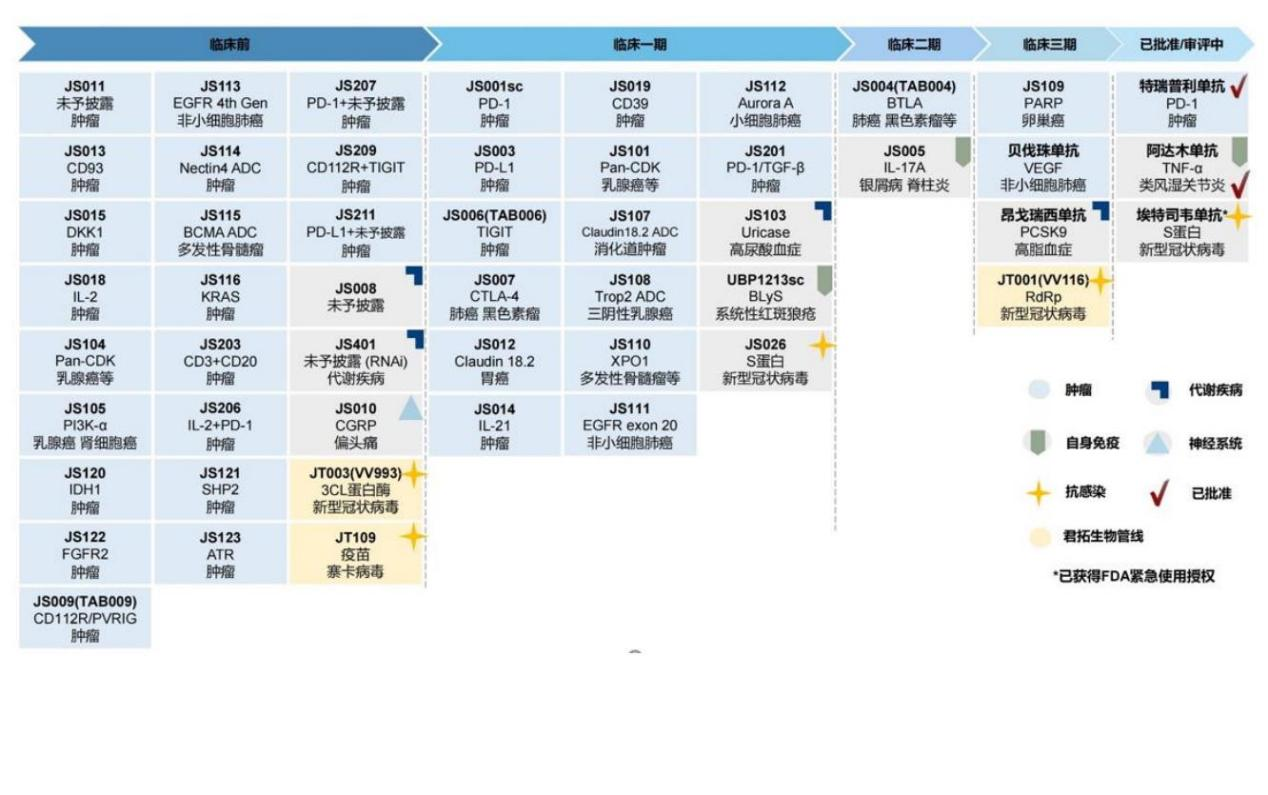
截至2022年3月31日,图片显示研发进展
2019 ~2021年,君实生物经营活动产生的净现金流量分别为-117,947.53万元、-145,637.66万元以及-60,505.00万元,公司需要通过股权和债务融资补充营运资金。
R&D和运营资金紧张,募资是一种回血的方式。对于君实生物来说,这关系到核心产品的研发进度和后续的开发布局。
在创新药物研发项目中,君实生物计划总投资460,304.00万元,实施主体为公司或控股子公司,其中拟投资368,220.00一万元,剩余的自筹资金投入。
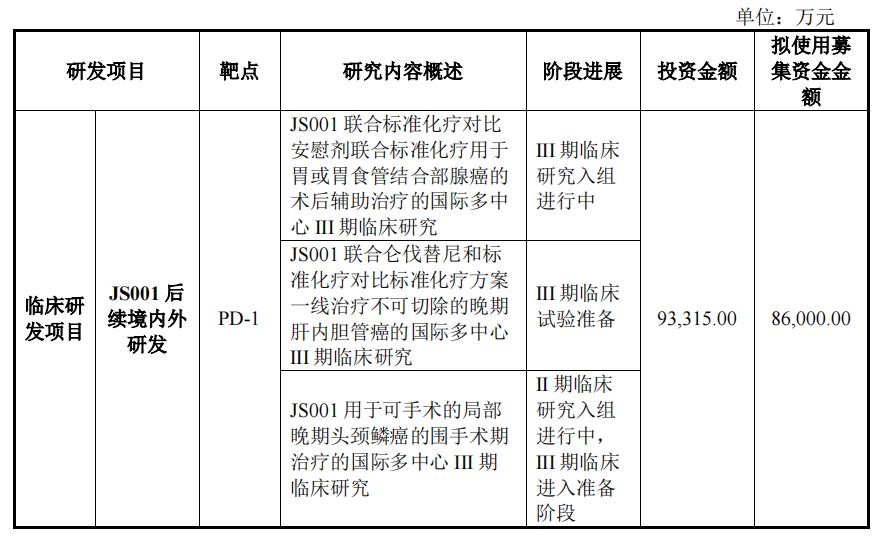
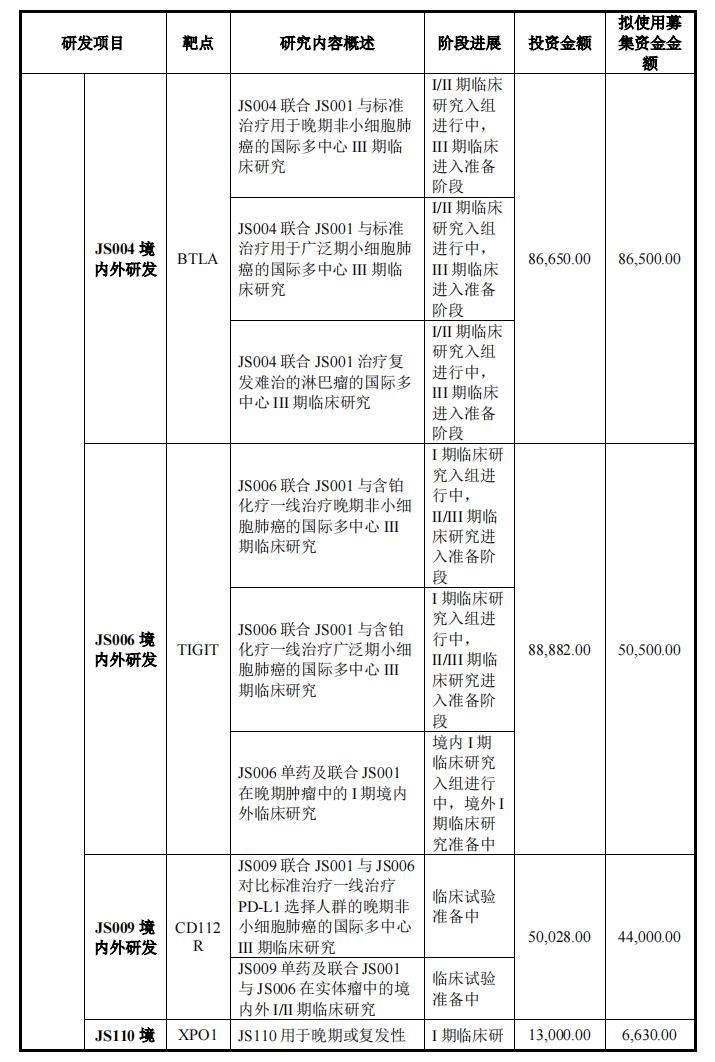
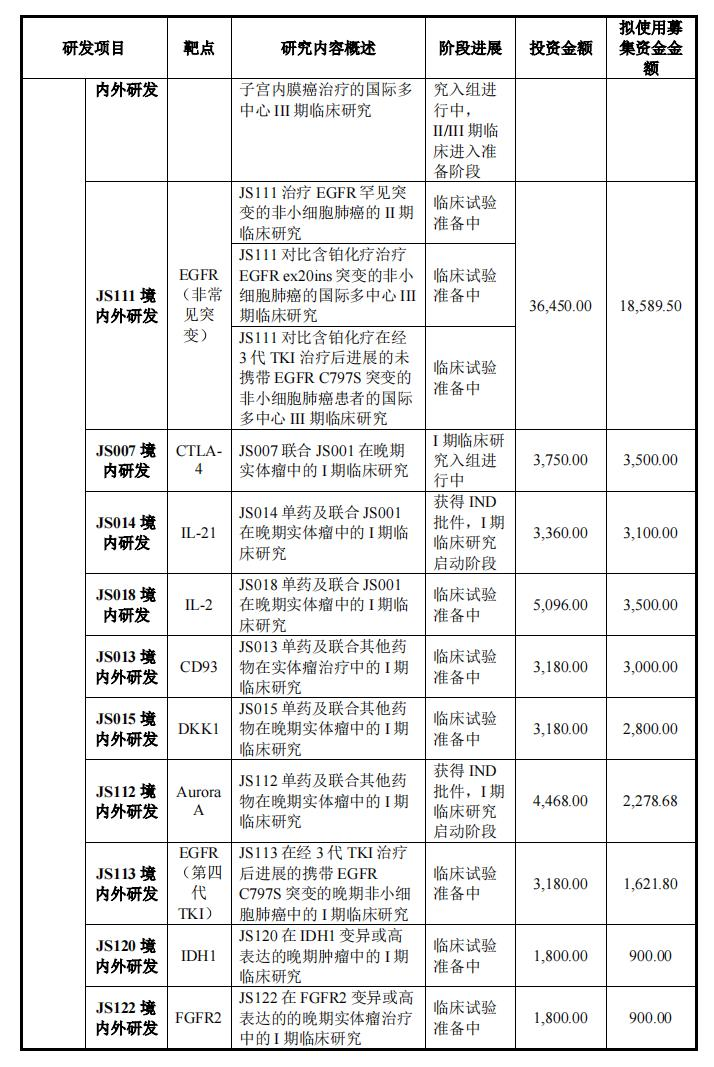
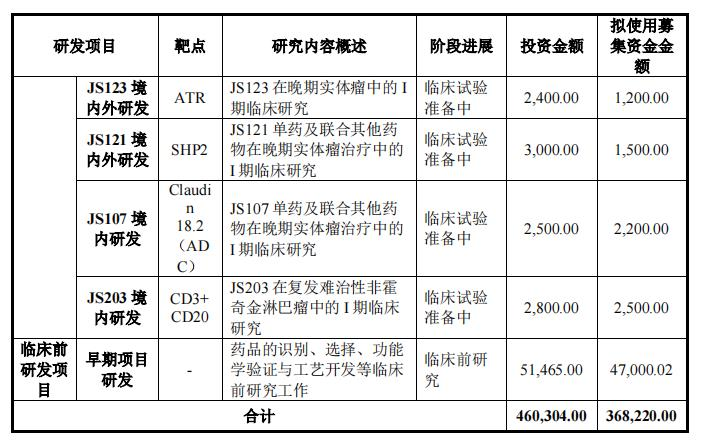
具体来说,在本次募集资金近40亿元中,君实计划使用募集资金36.822创新药物临床研究和临床前研究用于1亿元,包括JS001(PD-1)国内外后续临床研发,JS004(BTLA抗体)境内外III临床研究与发展JS111(EGFR exon20)临床前研究,如国内外临床研发项目和其他早期项目。
此外,君实生物计划在上海张江科学城上海国际医疗园区设立上海总部和R&D中心,总投资120,588.00计划使用募集资金2.978亿元。
据了解,君实生物本次发行的定价基准日是本次发行的第一天。本次发行的发行价格不得低于定价基准日前20个交易日(定价基准日除外)A80%的股票均价。
B
艰难行走:PD-1新冠中和抗体疗法隐忧
目前,君实生物处于商业化阶段,只有在研产品PD-1产品特瑞普利单抗、埃特司韦单抗和阿达木单抗(UBP1211)这3款。
君实生物的特瑞普利单抗是第一个国产的PD-1产品,但现在已经开始逐渐失去首发优势;它的埃特司韦单抗是一种重组的全源抗性SARS-CoV-2然而,随着新冠肺炎病毒的不断变异,单克隆中和抗体也给该产品未来的销售带来了一些不确定性。
2021年,受销售团队动荡、医保谈判、国内竞争产品等影响。,君实生物的特瑞普利单抗只卖了4.121亿元,同比下降近60%;2022年Q1实现销售收入1.1亿元,日益沦为普药PD-1产品,未来能否支撑君实生物,令人怀疑。
截至2022年3月31日,全球市场(包括中国市场)共有11款抗PD-1单抗产品获批,没有国产抗性PD-1海外市场批准单抗产品。
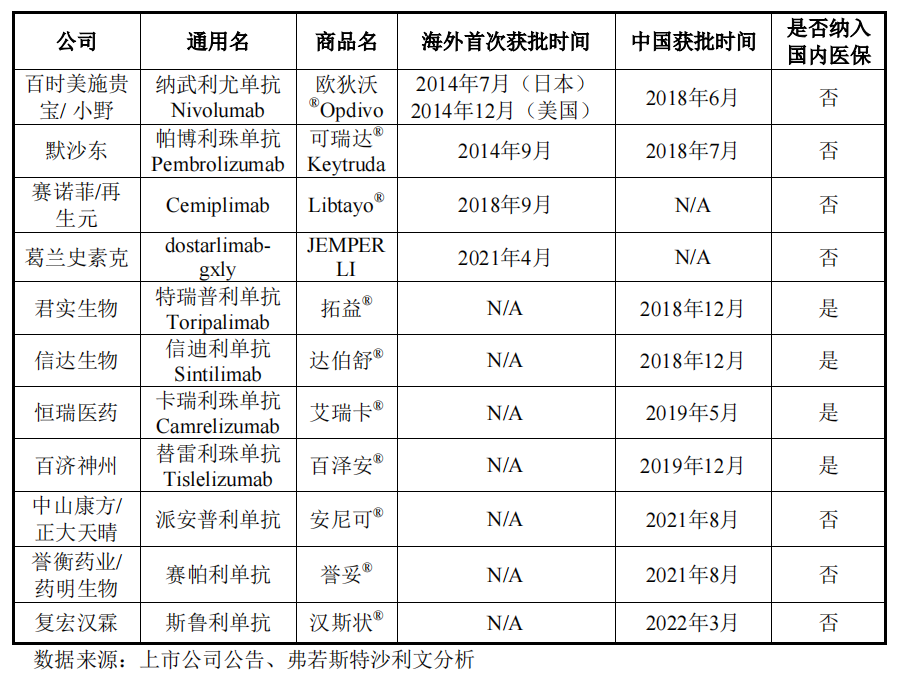
另一方面,受疫情影响,君实生物PD-1吉西他╱顺铂作为晚期复发性或转移性鼻咽癌患者的一线治疗,以及复发性或转移性鼻咽癌含铂治疗后的二线及以上治疗申请在美国延长。
海外上市的推迟无疑给君实生物带来了至少几个月的影响。然而,即便如此,出海计划仍然是君实的主要行动。在这次筹款中,君实生物被拿走了8.6亿用于PD-1国内外产品研究。
2021年,君实生物收入40.251亿元,来自技术许可和特许收入334111.79万元,占比为83.01来自礼来制药和礼来制药Coherus技术许可和特许收入分别为236596.78万元和97515.00万元。
20202000年5月,君石与李来签署了研发合作许可协议,李来被授予独家许可,在大中华区以外对埃特西韦单抗进行研发和商业化。根据协议,李来支付了1000万美元的首付款,并在实现了规定的里程碑事件后支付了最高金额2.45亿美元的里程碑,加上产品销售净额的两位数销售份额。
据了解,随着礼来的埃特司韦单抗1400mg与巴尼韦单抗(LY-CoV555)700mg2021年,双抗体疗法在全球15多个国家和地区获得紧急使用授权,并成功实现销售。君实已经达成了协议约定的所有里程碑事件,并确认了协议约定的所有里程碑收入。
随着COVID-19这种双抗体疗法在未来的销售中也面临着不确定性。因为,如果不能达到变异株的预期治疗效果,FDA礼来制药双抗体疗法的使用可能会继续受到限制,届时君实的销售分成收入将受到影响。
最近的数据显示,君实和礼来的埃特司韦单抗(etesevimab)与巴尼韦单抗(bamlanivimab)双抗体疗法,再生元casirivimab和imdevimab双抗体疗法对新冠肺炎奥密克戎变异株疗效不大。目前,奥密克戎变异株正在全球迅速传播。根据美国疾病控制和预防中心的说法,(CDC)据统计,截至2022年1月,奥密克戎占美国所有新病例的99%以上。
2022年1月,FDA宣布修改上述两种新冠肺炎双抗体疗法的紧急使用授权,仅限于对这些中和抗体敏感的突变株。2022年4月,数据显示,sotrovimab对于美国的主要变体来说,这是不可能的BA.2有效,FDA葛兰素史克宣布取消Vir新冠肺炎抗体疗法sotrovimab在美国的授权。
另一款UBP1211它是秀美乐的一种生物类似药物,于今年3月获批上市。截至2022年3月31日,中国市场已获批阿达木单抗产品7种(含一种原研药和6种生物类似药),市场竞争压力也不小。
C
生死竞速,君实生物的突破机会
新药研发,是一场与时间的赌博,这需要多少时间和运气的参与。
面对狡猾的新冠肺炎,君实生物也在研究口服药物——VV116,预计近期获批。VV116继续领跑国内新冠小分子赛道。
资料显示,VV116这是一种新型的口服核苷类抗性SARS-CoV-2药物,可以抑制SARS-CoV-2临床前研究表明,VV116体内外都表现出明显的抗阻力SARS-CoV-2作用,对SARS-CoV-2原始株和已知的重要变异株(Alpha、Beta、Delta和Omicron)具有较高的口服生物利用率和良好的化学稳定性。
20212000年9月,上海君拓与旺山旺水达成合作,共同承担VV116临床开发和产业化在合作区域。2021年12月,VV116获得乌兹别克斯坦EUA获批。
本周内VV116上海瑞金医院正式宣布Paxlovid480名患者全部入组,并在乌兹别克斯坦召开临床试验结果新闻发布会,披露当地价格为185美元。
预计国盛证券和Paxlovid头对头3期临床已完成入组,预计一个月内完成数据阅读,Q3有望获得紧急使用授权;VV116比如在国内批准上市治疗新冠肺炎,预计销售额将超过200亿元,归属公司项目价值约241亿元。
现在包括君实VV116国内口服药有三种,即将获批。中国有10多种新冠口服药正在研究中,竞争相当激烈;疫情反复,相关药物的研发进展备受关注。最近有消息说,10uM(微摩尔/升)千金藤素抑制冠状病毒复制的倍数是15393倍,特效药的竞争也让市场难以琢磨;此外,以前是真实的VV116临床试验中也暴露出患者胃肠痉挛,约10%的患者会出现,副作用等也可能给批准带来不确定性;新冠肺炎药物的研发是否顺利也受到疫情变化的影响。
新药研发投入大,风险高,开发新冠药,更是一场生死之争。
总的来说,目前君实生物的核心项目仍然是新冠肺炎口服小分子药物VV116、PD-1特瑞普利单抗抑制剂BTLA单抗等。
510月13日,特里普利单抗被批准用于食管鳞状细胞癌的一线治疗。它已成为第一个年度新增患者超过20万大适应症,为产品开发开辟了一个新阶段。2022年,特里普利单抗可能取得以下进展:1.联合标准一线化疗被批准用于晚期非小细胞肺癌的新适应症,未经治疗,驱动阴性基因;2.广泛期小细胞肺癌一线治疗、肝癌辅助治疗、肝癌一线治疗等III预计临床研究将实现数据读出。
此外,BTLA单抗临床数据将为ASCO2022年公布,更多的早期管准备就绪。公司将披露Icatolimab在中国和美国,国际创新已经形成了用于淋巴瘤和实体瘤治疗的单药或联合特瑞普利单抗的早期临床结果。在这次募资中,君实生物也拿出了比较PD-1还有更多的研发资金,用于研发BTLA国内外单抗研发。
此外,君实生物还有一些潜在的早期管道,可以赋予公司长期发展,比如CD112R(PVRIG)是从源头参与发现的新的免疫检查点路径,差异化发展JS009(CD112R)、JS006(TIGIT)与特瑞普利单抗的联合战略有望继续改善T改善恶性肿瘤的临床疗效等。
在本次募资手册中,君石生物也坦言,如果未能通过计划融资渠道及时获得足够的资金,或者公司筹集的资金未能按计划配置使用,或者资金使用效率未能如公司所愿,可能会给公司带来短期流动性风险。如果公司无法获得足够的营运资金,将被迫推迟、减少或取消研发项目,这将进一步影响未来药品的商业化进程,并对公司的业务产生不利影响。
一旦新药研发开始,就没有回头路了。经营亚历山大,即使亏损多年,君实生物也要向投资者要钱,成败都在这场生死大赛中。
资料参考:君实生物公告、国盛证券等
