研究报告 | 靶向GITR研究药物清单
01 GITR靶点简介
糖皮质激素诱导的肿瘤坏死因子受体相关蛋白质(Glucocorti-coid-inducedTNF receptor-related protein,GITR/TNFRSF18)属于肿瘤坏死因子(TNF)受体超家族,其配体为GITRL/TNFSF18。GITR主要表达在胸腺、脾脏和淋巴结中T小鼠中的淋巴细胞GITR持续高表达Treg细胞,尽管处于静息状态NK细胞、效应T淋巴细胞、B淋巴细胞中GITR表达水平很低,但细胞活化后GITR表达显著增加。GITRL主要表达在抗原递质细胞中,包括内皮细胞、树突细胞(DC)、巨噬细胞等。
作为重要的T淋巴细胞协同刺激分子,GITRL可以直接与GITR特异性结合也可以在酶切后形成可溶性细胞外段和GITR特异性结合不仅具有促进作用T淋巴细胞增殖和细胞因子分泌也可以调节Treg增殖和抑制作用T淋巴细胞的功能可以起到调节作用T淋巴细胞功能的作用。因此,对肿瘤免疫治疗、激活和激活T细胞表面的GITR更有前途的治疗方法之一。
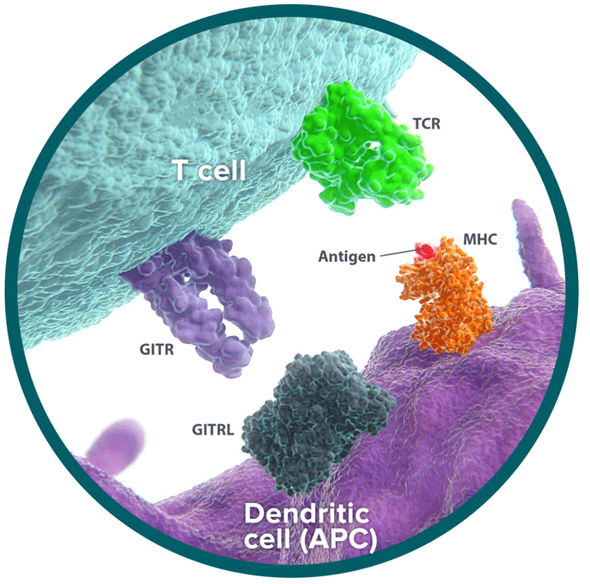
图:GITR/GITRL示意图
02 GITR研究药物清单
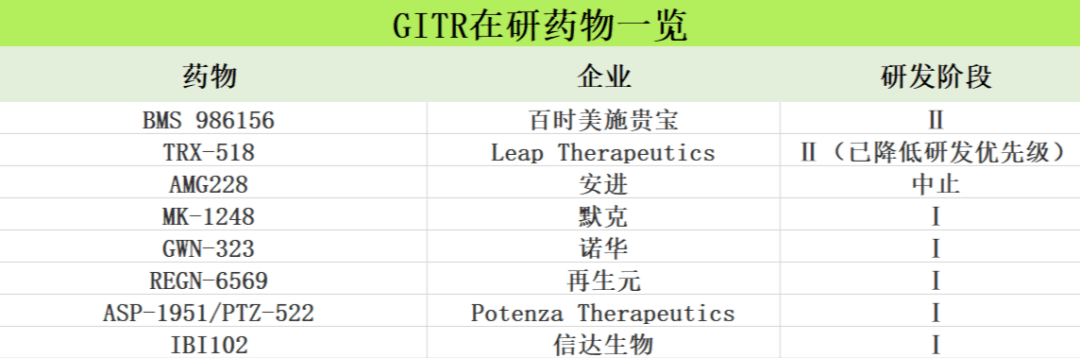
鉴于GITR潜在的抗肿瘤作用,许多制药企业将目光投向GITR单抗的研发,大部分药物仍处于早期研究阶段,尚未获批上市。国内信达生物布局GITR单克隆抗体,IBI1022020年10月获得默示许可批准。
(1)BMS 986156是BMS在研的一款GITR激动剂目前处于临床实践中Ⅱ期。2020年,JAMA杂志公布了BMS 986156的Ⅰ临床试验结果。共有292名晚期实体瘤患者,34名患者每两周接受一次。10~800mg的BMS 986156单药治疗;258名患者每两周接受一次治疗;30~800mg的BMS-986156和240mg~480mg的O药治疗。
试验结果显示,单药治疗组未观察到客观缓解,34%的肿瘤患者病情稳定(SD),三级以上没有发生TRAE。在联用组中,观察到2例完全缓解(CR=0.7%),均在240mg BMS 986156和240mg O药组中;PR=7.4(19/258)。BMS 986156与O药联用实现7.5客观缓解率为%,DCR达39.84%。安全方面,24名患者(9.3%)经历了3-4级TRAE,未发生5级TRAE。
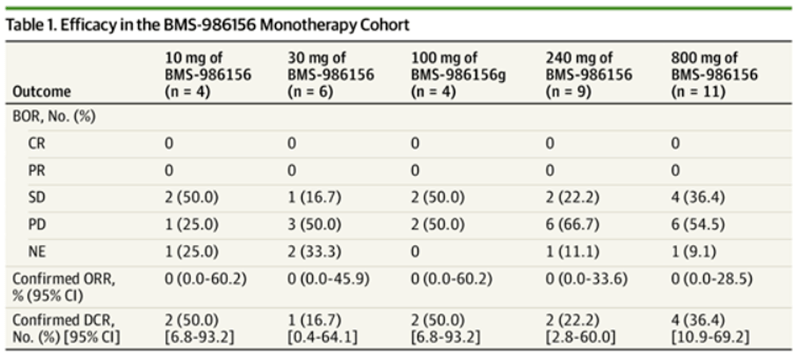
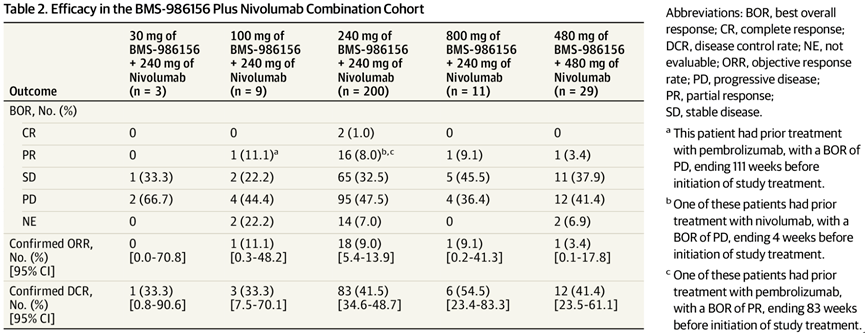
图:BMS986156单组和联用组试验结果
数据来源:JAMA
(2)AMG228是安进研发的靶向目标GITR人源IgG1单克隆抗体,适应症为实体瘤。AMG228的一项Ⅰ研究人员包括非小细胞肺癌、头颈鳞状癌、黑色素瘤等30名晚期肿瘤患者。AMG228每三周注射一次,结果表明药物安全性良好,即使在最高剂量组中(1200mg)没有剂量限制性毒性(DLT),但单药治疗并未表现出抗肿瘤活性。考虑到这一点。AMG228疗效平庸,安进终止了该品种的研发。
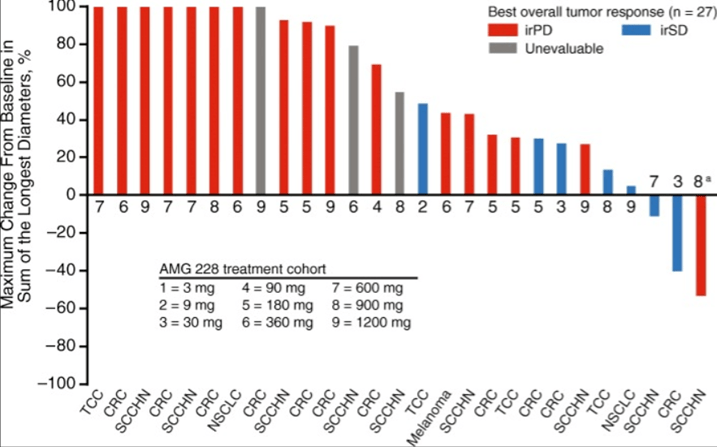
图:AMG228疗效数据
数据来源:PubMed
(3)MK-1248是默克公司开发的一款默克公司GITR单抗,目前正处于临床实践中Ⅰ期。在2018ASCO上面,默克披露了MK-1248的Ⅰ临床试验结果。试验包括37名患者,其中20人每三周接受一次MK-1248单药治疗,最大剂量为170mg;17名患者接受MK-1248和K药(PD-1抑制剂)联合治疗,最大剂量为60mg,K药物的剂量是固定的200mg。
在安全方面,没有剂量限制性毒性,也没有治疗相关死亡。在疗效方面,单药组没有观察到明显的缓解,15%的患者肿瘤保持稳定(SD);17接受联合治疗的患者客观缓解率为18%,其中1例完全缓解,2例部分缓解(PR=11.7%),DCR=41%。总的来说,MK-1248安全性好,和PD-1抑制剂的联合疗法表现出一定的抗肿瘤活性。
(4)GWN-323是诺华研发的靶向型GITR人源IgG1单克隆抗体目前处于临床实践中Ⅰ期间。2021年,诺华披露GWN-323的Ⅰ/Ⅰb共有92名患者被纳入期剂量递增试验结果,其中39名患者被接受GWN-323单药治疗,最大剂量为1500mg;53名患者接受GWN-323和spartalizumab(PD-1单抗)治疗,GWN-323最大剂量为750mg,spartalizumab剂量为100-300mg。
安全方面,在GWN-323单个药物组没有观察到剂量限制性毒性。联用组观察到三种以上剂量限制性毒性,包括呼吸衰竭和小肠梗阻。与治疗有关的毒性发生在82.1单药组及%77.4%的联用组。
疗效方面,单药组7名患者肿瘤保持稳定(SD=17.9%),没有明显的缓解。在联用组中,客观缓解率(ORR)达7.5%,其中一名子宫内膜瘤患者出现完全缓解,3名患者部分缓解,14名患者病情稳定,DCR达33.96%。
(5)TRX518是Leap Therapeutics公司开发的一款GITR激动剂目前处于临床实践中Ⅱ期。TRX518独特的设计在于敲除Fc为防止抗体药物误伤表达GITR受体细胞提高了药物的安全性。该公司指出,Fc端敲除的GITR与激动剂相比Fc端的GITR激动剂不仅提高了安全性,而且具有显著的疗效优势。
001是公司的目标TRX518单药试验,研究未达到MTD,仅发生少量TRAE,在疗效方面,研究表明,一些患者发现了免疫系统的激活。此外,公司还开展了另一项工作。TRX518单药试验(003),肝细胞癌患者部分缓解,肿瘤大小降低47%,PR=5%(1/20)。
TRX518单药疗效数据非常有限。公司认为,TRX518成熟细胞本身不能逆转T细胞衰竭,但添加PD-1抑制剂可以克服这一障碍。该公司进一步探索了这一点。TRX518与PD-1抑制剂的联合疗法包括帕博利珠单抗和纳武利尤单抗。一个接受的接受者。TRX518与K药物食管鳞癌患者出现完全缓解,缓解持续时间接近2年;一名接受的人接受了它;TRX518与O尿路上皮癌患者部分缓解,缓解持续6个月。
2019年11月,公司宣布减少TRX518研发的优先级。目前,在公司官网上,很难找到。TRX518公司将研发重点放在有针对性的跟踪上DKK1的拮抗剂DKN-01。
(6)国内布局GITR目标企业少,信达生物企业少,信达生物企业少IBI102是一款抗GITR2020年10月10日,单克隆抗体被临床默示许可,计划用于晚期恶性肿瘤。
小结
目前,全球布局GITR激动剂企业较少,国内只有信达生物IBI1022020年底获批临床。从疗效的角度看,GITR激动剂单药疗效非常平庸,Leap Therapeutics认为GITR激动剂不能逆转成熟T细胞衰竭,因此很难缓解疾病。
与PD-1抑制剂的共用方案可能是GITR激动剂救命策略,诺华的GWN-323联用PD-1抑制剂可以完全缓解子宫内膜患者,显示出一定的治疗前景。一般来说,作为免疫检查点的激动剂,它是针对免疫检查点的GITR靶点可开发的适应症很广,但仍面临许多临床挑战。
