后PD-1时代 双抗热点爆发 500亿市场即将开放
近年来,肿瘤治疗已进入免疫治疗时代,特别是抗癌治疗时代PD-1以单抗为代表的免疫检查点抑制剂进展最快,在多个实体瘤领域取得突破。然而,由于患者响应人数少、耐药性高等缺点,免疫检查点抑制剂的应用限制了其在临床实践中的推广应用。目前,有几种可行的方法可以有效突破免疫单药的困境:
- 采取抗PD-(L1)探索单抗、放疗、化疗、靶向等联合治疗的适应症。目前,联合免疫计划已经改写了许多肿瘤的标准治疗计划。
- 挖掘其他潜在的可成药靶点,但LAG3、TIGIT免疫检查点单药治疗效果有限,目前正在尝试联合抗抗药PD-1单抗扩展适应症。
- 除了关注免疫检查点,很多企业开始关注免疫检查点,T细胞激动剂的研发包括靶向激动剂OX40、CD27、CD40、GITR和4-1BB抗体。但由于毒性问题,激动剂的进展比免疫检查点的抑制剂慢,尚未获批上市。
- 以PD-(L)1双抗和多抗技术迭代升级为基本靶点,如PD-1/CTLA-4、PD-L1/CTLA-4等双免疫检查点双抗,也有企业在布局上PD-L1/4-1BB免疫检查点与激动位点的双抗结合。
PD-1/CTLA-4双抗
PD-1和CTLA-4最经典的双免疫组合方案是纳武利尤单抗和伊匹木单抗。O Y该组合已应用于许多癌种的适应症,包括肝癌、黑色素瘤等。但由于原因。CTLA-4单抗的剂量依赖性毒副作用,使联合疗法,CTLA-4单抗治疗剂量有限。因此,迫切需要找到安全有效的方法,靶向治疗。PD-1和CTLA-4双特异性单克隆抗体是一种很好的设计方法。
康方生物 AK104
PD-1/CTLA-4双抗
布局PD-1/CTLA-4双抗企业众多,进展最快的是国内康方生物自主研发产品AK104。
2021年9月,CDE卡度尼利单抗已经受理(AK104)治疗复发/转移宫颈癌的新药上市申请,并给予优先考核资格。
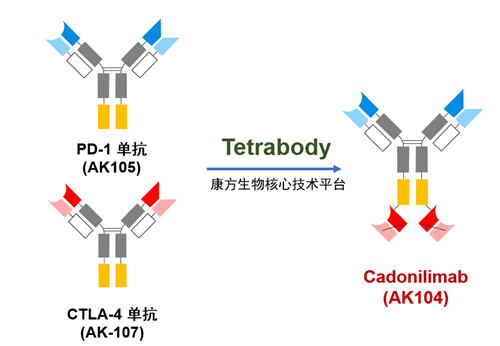
图1. Tetrabody技术平台
双抗是以康方生物为基础的。Tetrabody核心技术平台将自主研发、批准上市的康市的抗技术平台PD-1单抗(派安普利单抗)的所有结构和授予默沙东的抗CTLA-4单抗(AK107、MK1308)的scFv片段结合,最终形成靶向PD-1和CTLA-4靶点人源化四聚体双特异性抗体—AK104。
AK104作用机制如下:
与正常组织和外周血细胞相比,肿瘤浸润淋巴细胞共同表达PD-1和CTLA-4因此,抗性水平要高得多,因此,抗性水平要高得多,PD-1/CTLA-4双特异性抗体在肿瘤组织富集方面优于正常组织,有助于提高疗效和安全性。
目前可用于联合治疗的抗PD-1和抗CTLA-4抗体,在应用中,Fc段所介导的ADCC、ADCP对疗效和安全也有很大的影响。
此外,肿瘤微环境中活化的巨噬细胞分泌促炎细胞因子,如IL-6和IL-8,在介导免疫抑制中起着关键作用。Fc段落改造,旨在消除与FcγRs和C1q结合最大限度地减少淋巴细胞损失和巨噬细胞释放抗体依赖性细胞因子,有效减少irAE免疫治疗中的不良预后。
综上可见,AK104其作用机制强调了肿瘤富集的优点。巧合的是,阿斯利康的作用机制强调了肿瘤富集的优势。MEDI5752(PD-1/CTLA-4双抗),在其机制介绍中,也提到了肿瘤富集的作用优势。
阿斯利康 MEDI5752
PD-1/CTLA-4双抗
MEDI5752,是一种工程改造,减少了FC效应器功能单价双特异性人IgG1单克隆抗体。
MEDI5752采用的是DuetMab技术,即二硫键移位,避免轻链错配。由于单价形式,MEDI5752对于PD-1和CTLA-4阻断效应减弱。
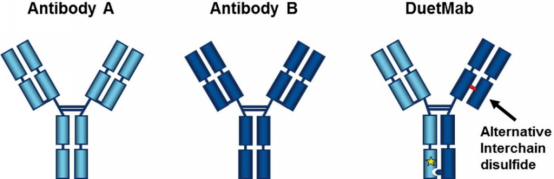
图2. DuetMab技术
虽然价格状态和结构与AK104不一样,但在《Cancer Discovery》上发表的MEDI5752基础研究试验结果为基础研究试验结果PD-1/CTLA-4双抗在临床上表现出更好的疗效,更低的毒性效果给出了具体的机制。
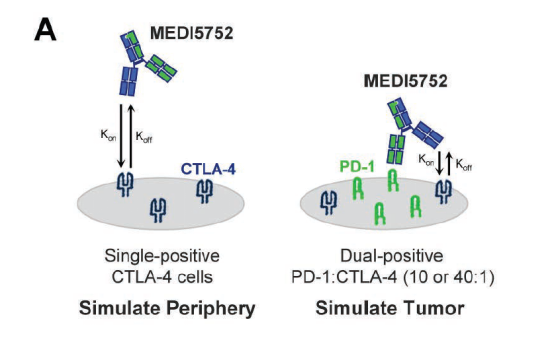
图3. MEDI5752的靶点结合
MEDI5752对活化的PD-1 T细胞的CTLA-4优先抑制。如上图所示,与上图所示,与。PD-1-T细胞相比,MEDI5752优先饱和PD-1 T细胞的CTLA-4。
此外,值得一提的是,MEDI5752也会导致PD-1内吞和降解可优先考虑肿瘤微环境(TME)中阻断中积累PD-1与此同时,在TME提供更强的CTLA-4抑制作用PD-1和CTLA-4与单抗组合相比,表现出增强的抗肿瘤活性。
2022年的AACR摘要显示,在一期临床试验中,该疗法在治疗不适合标准治疗的晚期实体瘤患者时表现出可喜的抗癌活性。
综合不同剂量,客观缓解率为19.8%,中位缓解持续时间为%17.5一个月。生物标志物分析显示MEDI5752强力阻断PD-1和CTLA-4信号传输并显示已有或新扩展T细胞克隆的潜力。
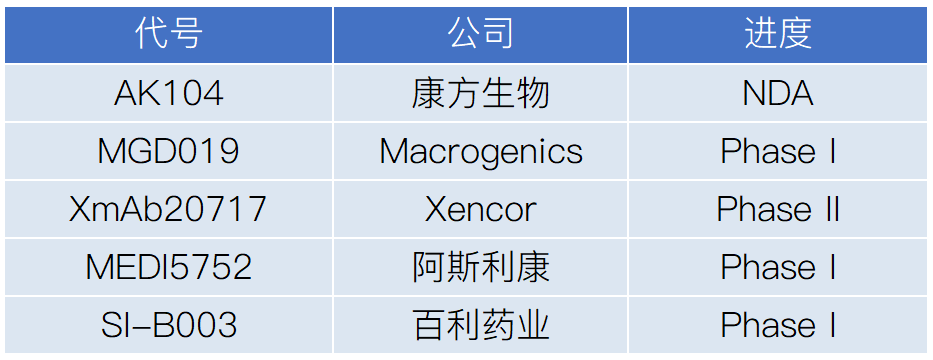
图4. 在研PD-1/CTLA-4双抗
除了PD-1/CTLA-4除了双抗有很多企业布局外,PD-L1/CTLA-4双抗也是目前的研究热点,进展最快的是康宁杰瑞KN-046。

图5. KN046晶体结构
KN046康宁杰瑞自主研发。PD-L1/CTLA-4双特异性抗体的创新设计包括:不同机制的使用CTLA-4与PD-L1单域抗体融合组成可靶向富集PD-L1高表达的肿瘤微环境和抑制肿瘤免疫的清除Treg。多个实体瘤项目已经推广到III期阶段。
PD-1/LAG 3双抗
LAG-3(淋巴细胞活化基因3)是抑制性免疫检查点,主要在抑制性免疫检查点T细胞表达的作用机制如下:
主要与MHC II结合,负调节T细胞增殖和活化;
可与Galectin-3、LSECtin结合起来,影响 T 细胞功能;
纤维蛋白原样蛋白1(FGL1)结合,促进肿瘤免疫逃逸。
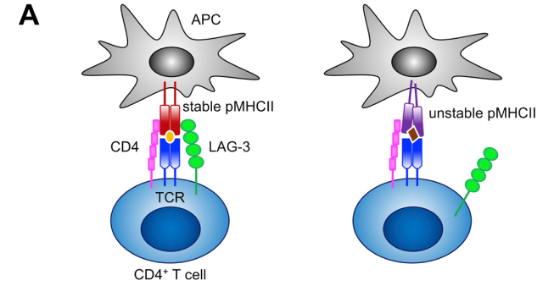
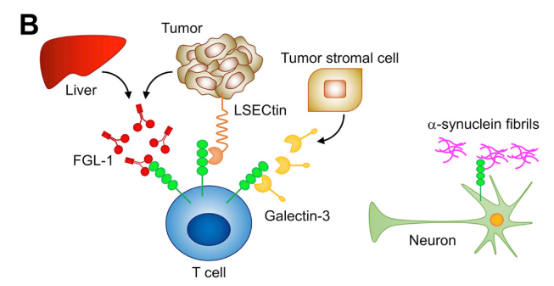
图5. LAG-3靶点的作用机制
2022年3月18日,FDA正式批准贵宝公司抵抗力LAG-3单抗(Relatlimab)联合自己的抵抗PD-1单抗(Nivolumab)用于治疗转移性黑色素瘤。Relatlimab由此成为施贵宝公司Nivolumab、Ipilimumab第三款免疫检查点抑制剂获批上市。
对LAG-3单抗方面,单药治疗效果有限,联合抗PD-1单抗扩展适应症已成为研发的主流趋势。随着双特异性抗体的普及,一些企业开始加快布局PD-1/LAG-3双抗。
例如,罗氏开发PD-1/LAG-3双抗(RO7247669注射液)积极开展全球1/2期临床试验,包括晚期肝细胞癌、转移性黑色素瘤、非小细胞肺癌、食管鳞状细胞癌、转移性食管癌等。
国内布局企业有:岸迈生物(EMB-02,PD-1/LAG-3双抗)、康方生物(AK-129,PD-1/LAG-3双抗)、再鼎药(MacroGenics合作的MGD013,PD-1/LAG-3双抗)。
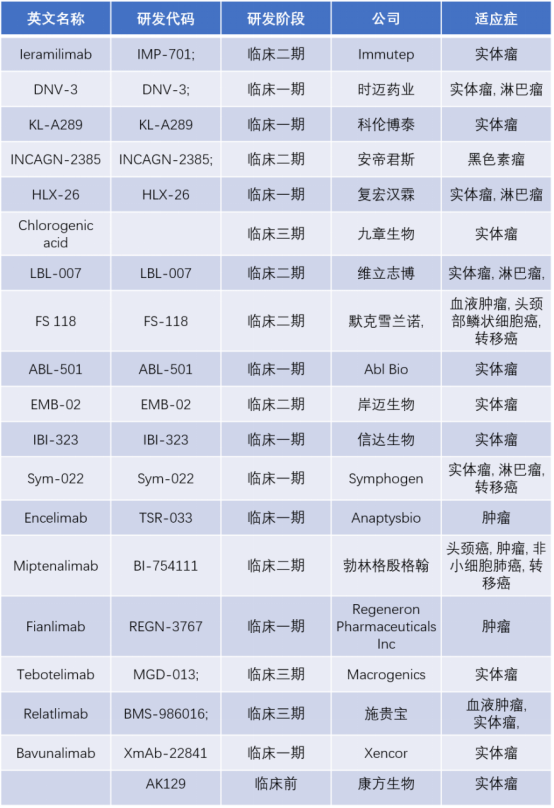
图6. PD-1/LAG3双抗在研产品
PD-L1/TGF-β 双抗
近年来,靶向肿瘤微环境相关因素的双抗也逐渐增多,包括靶向肿瘤微环境相关因素VEGF、VEGFR2、TGF-β等等,最具代表性的是PD-L1/TGF-β双抗,但大多是失败的例子。
20218月23日,德国默克宣布终止 M7824(PD-L1/TGFβ双抗)联合化疗治疗胆管癌二期临床,因为不太可能实现胆管癌的实现OS终点,研究没有发现新的安全信号。终止也成为一种终止方式。M7824第三项临床研究失败。过去有两项试验(肺癌、胆管癌二线)未能达到预期。
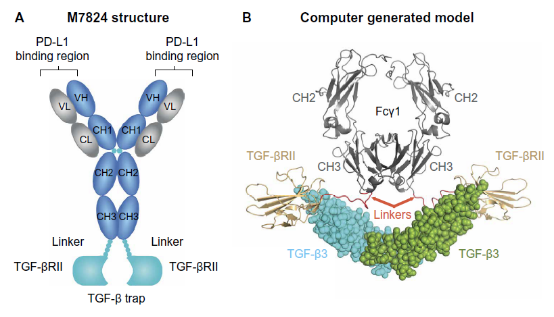
图7. M7824结构和模型
理论上,TGF-β它是一种肿瘤促进因子,通过诱导免疫逃逸,促进血管形成,诱导上皮间质转化,促进肿瘤细胞的生长、渗透和转移。PD-L1它还表达在肿瘤细胞上PD-L1和TGF-β这两个靶点应带来明显的抗肿瘤活性。M7824连续失败,为PD-L1/TGFβ双抗研发的未来蒙上了阴影。
PD-L1/4-1BB 双抗
PD-L1/4-1BB双抗,进展最快的是BioNTech公司的GEN1046(PD-L1×4-1BB)双抗,最近,也发表了,GEN1046临床前人体特征及首次人体研究结果。
GEN1046是一个全长IgG1亚型、 PD-L1×4-1BB双抗,使用DuoBody?技术平台,通过单克隆全人源,PD-L1和人源化4-1BB抗体的Fab基于双特异性模式异性模式的体外生物活性选择母代PD-L1和4-1BB抗体。母代抗体包含CH3结构域的对应突变F405L/K409R(促使Fab臂异源二聚化,产生双特异性分子)和Fc沉默突变 L234F/L235E/D265A(阻止结合FcγR和C1q,去除ADCC、ADCP和CDC效应)。
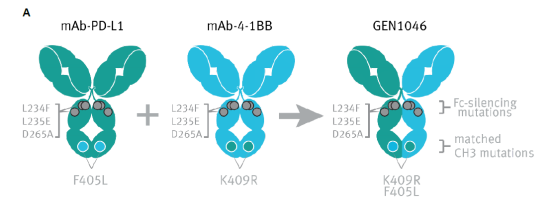
图8. GEN1046的结构
I/IIa期试验(NCT03917381)剂量递增阶段共计入61例晚期实体瘤患者,接受GEN1046 9个递增剂量水平(25-1200mg Q3W),常见的肿瘤类型有12例结直肠癌、9例卵巢癌、6例胰腺癌、6例胰腺癌NSCLC。入组患者均接受过多线治疗,中位治疗线数为3(范围:1~11)。24例(39.3%)患者最近接受系统抗肿瘤治疗的最佳缓解方法(PD);23例(37.7%)患者过去接受过一种PD-(L)1抑制剂,其中8例(34.8%)患者最近接受了PD-(L)1缓解抑制剂的最佳方法是PD。
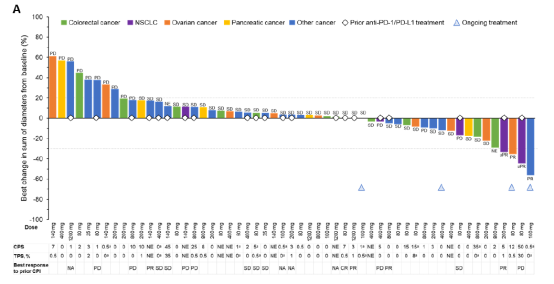
图9. GEN1046晚期实体瘤患者抗肿瘤疗效
初期表现出良好的临床治疗效果和安全性,期待更多样本量的研究数据积累。
国内布局这一目标的双抗多抗企业也较多,都处于临床早期阶段,总结如下:
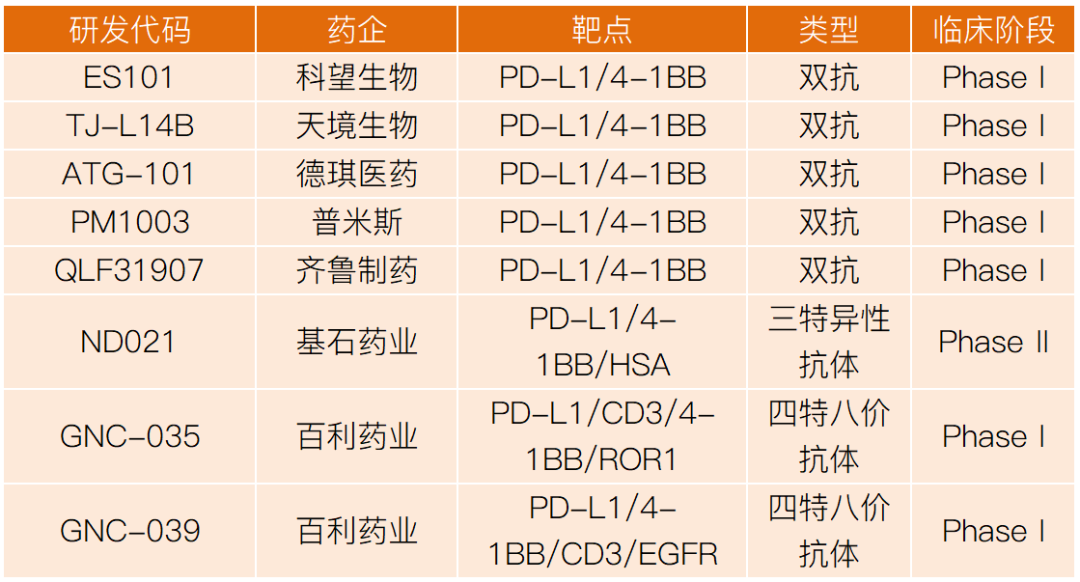
图10. 国内4-1BB双抗和多抗在研产品
双抗联合双抗
基于双抗的安全性和抗肿瘤活性,许多企业开始尝试基于双抗的多靶点联合方案。
20222000年1月5日,康芳生物宣布自主研发的世界首款新型肿瘤免疫治疗新药AK104 (PD-1/CTLA-4联合双抗、卡度尼利单抗)AK112(PD-1/VEGF双抗)Ib/II申请期临床试验CDE晚期非小细胞肺癌联合或非联合化疗治疗(NSCLC)。
康宁杰瑞也在尝试KN026(HER-2/HER2双抗)联合KN046(PD-L1/CTLA-4双抗)治疗HER-2阳性实体瘤的疗效和安全性。
2022年AACR会议还公布了初步结果。截至2021年8月10日,共有24例入组接受。≥1L系统治疗、HER2阳性非乳腺癌、胃癌、局部晚期不可切除或转移性实体瘤患者至少接受一次肿瘤评估:客观缓解率(ORR)为55.0%,疾病控制率 (DCR) 为85.0%,6个月的PFS率为84.1%;其中11名可评估结直肠癌患者ORR和DCR分别为45.5%和90.9%。
总结
目前已成为继承者PD-1、CAR-T、抗体偶联药物等热门赛道之后的另一个热风口。随着新双抗进入市场,双抗获得更多适应证,2025年双抗全球市场规模将超过500亿元。为此,全球制药巨头纷纷加入研发大军,开启竞争模式。
鉴于双抗药物研发逐渐火爆,为防止无效竞争和医疗资源浪费,为进一步规范双特异性抗体抗肿瘤药物临床研发,CDE发布《双特异性抗体抗肿瘤药物临床研发技术指导原则(草案)》,征求行业意见。对双抗体从业者提出了更高的要求,如何有效弥补免疫单抗药物不能满足的临床需求,目标选择是否合理,是亟待解决的问题。

