202211种基因疗法有望获得美国FDA批准或提交监管申请
自2017年8月(Kymriah)tisagenlecleucel自美国首次批准治疗急性淋巴细胞白血病以来,美国至少有8种基因疗法获得了美国FDA批准上市,包括最近批准的上市,包括Carvykti(ciltacabtagene autoleucel),详见下表。
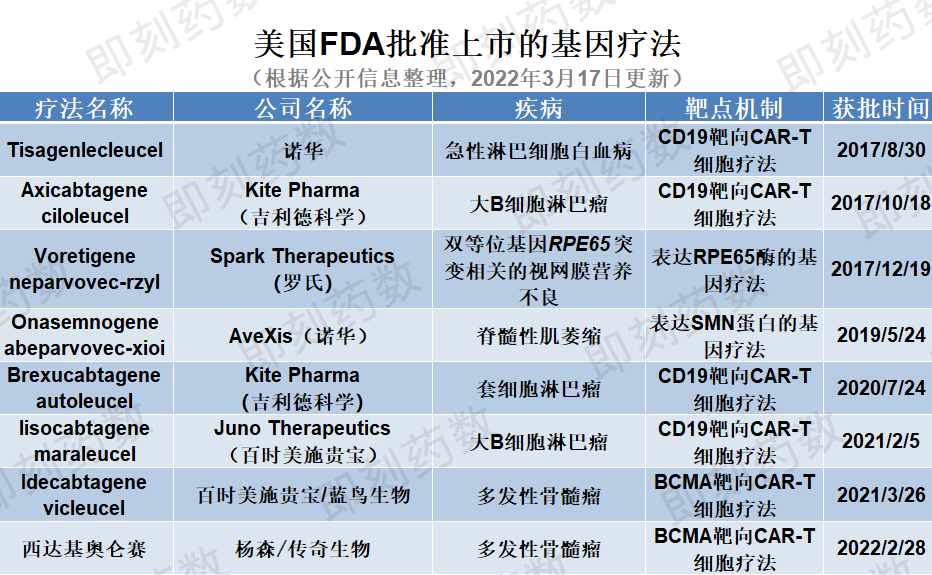
(药明康德内容团队绘图,点击可见大图,括号公司收购产品研发公司)
刚刚过去的2月,已经有杨森了(Janssen)与传奇生物联合开发Carvykti获得FDA今年有三种基因疗法可能获得批准FDA另外8种预计将在年底前提交生物制品许可证申请(BLA)。
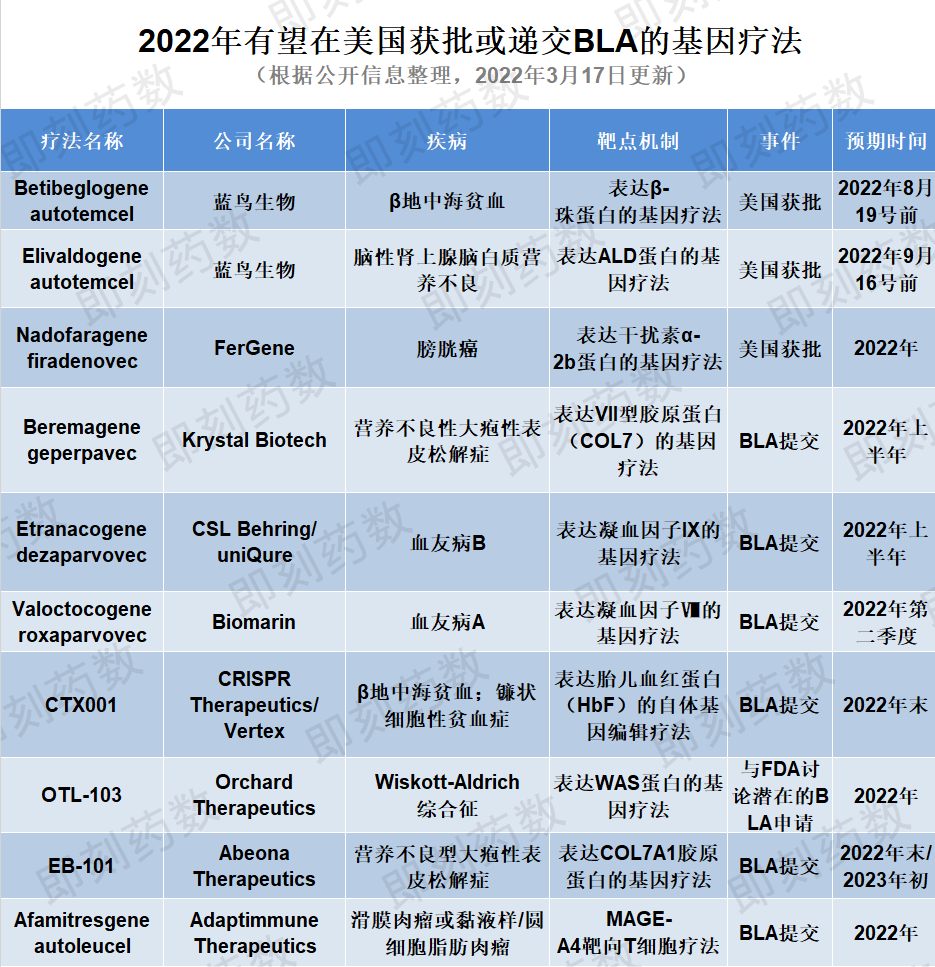
(药明康德内容团队制图,点击可见大图)
1. 疗法名称:Betibeglogene autotemcel
公司名称:蓝鸟生物
适应症:β地中海贫血
2022蓝鸟生物公司有两种基因疗法FDA批准。Betibeglogene autotemcel(beti-cel)是一种需要常规血红细胞输注的造血干细胞体外基因疗法β地中海贫血患者。该疗法将造血干细胞从患者体内分离出来,并利用病毒载体引入能够行使正常功能的修饰性病毒载体β球蛋白基因是一种潜在的一次性治疗基因疗法。目前应该是这样。BLA正在接受申请FDA审评,PDUFA目标日期为2022年8月19日。蓝鸟生物预计将于2022年8月19日设定。FDA外部专家委员会将于2022年6月召开会议讨论此申请。目前,该疗法已获得。FDA优先考核资格,取得优先考核资格的,取得优先考核资格的,FDA预计该疗法将成为美国第一个潜在的批准β慢病毒载体基因治疗地中海贫血患者。
2. 疗法名称:Elivaldogene autotemcel
公司:蓝鸟生物
适应症:脑肾上腺脑白质营养不良
FDA蓝鸟生物的第二种基因疗法是elivaldogene autotemcel(eli-cel),治疗18岁以下携带ABCD1早期脑性肾上腺脑白质营养不良患者基因突变(CALD)。这种疾病是由于ABCD1这种突变影响了基因突变ALD蛋白质的产生导致长链脂肪酸(VLCFAs)毒性积累主要发生在肾上腺、大脑和脊髓的白质中。FDA正在审评该BLA申请,PDUFA目标日期为2022年9月16日。beti-cel蓝鸟生物也是如此FDA外部专家委员会将于2022年6月召开会议。
3. 疗法名称:Nadofaragene firadenovec
公司名称:FerGene(Ferring)
适应症:膀胱癌
2022年FDA正在审查的基因疗法还包括nadofaragene firadenovec(Instiladrin),由Ferring Pharmaceuticals的子公司FerGene用于治疗对卡介苗(BCG)晚期高级非肌层浸润性膀胱癌反应不佳(high grade NMIBC)。Nadofaragene firadenovec芬兰基因疗法公司FKD Therapies开发,Ferring在2018年与FKD Therapies合作共同开发这种基因疗法,并将这种资产转移给FerGene公司。这种全新的基因治疗机制可以将患者自身的膀胱壁细胞转化为制造各种干扰素的微型工厂,增强身体抵抗癌症的自然防御能力。2019年,积极的三期结果表明,该疗法已达到主要疗效结束,具有良好的安全性和耐受性。FDA曾授予其快速渠道资格、突破性疗法认定和优先评价资格,并接受提交BLA。如果2022年获得批准,该疗法将是对的BCG无反应的NMIBC病人提供了有希望的选择。
4. 疗法名称:Beremagene geperpavec
公司:Krystal Biotech
适应症:营养不良大疱性表皮松解症
在美国提交BLA基因治疗候选药物,首先介绍的是Krystal Biotech的beremagene geperpavec,一种表达VII型胶原蛋白(COL7)局部基因疗法用于治疗营养不良性大疱性表皮松解症(DEB),这是一种罕见而严重的疾病,影响皮肤和粘膜组织。该疗法旨在为患者的皮肤细胞创造正常的皮肤细胞COL7蛋白质模板,分子水平治疗DEB。继2021年11月公布的积极安全性和有效性三期结果后,公司有望于2022年上半年前往美国FDA提交BLA。
5. 疗法名称:Etranacogene dezaparvovec
公司:uniQure、CSL Behring
适应症:血友病B
Etranacogene dezaparvovec由uniQure与CSL Behring合作开发旨在使用腺相关病毒5(AAV5)载体传递表达FIX Padua变体基因用于治疗中重度至重度血友病B。三期试验已证明安全,达到主次疗效终点。CSL该疗法计划于2022年上半年在美国和欧盟提交上市申请。若获得批准,etranacogene dezaparvovec可能是第一个潜在的血友病B患者提供持久、功能性治疗的基因疗法。
6. 疗法名称:Valoctocogene roxaparvovec
公司名称:BioMarin Pharmaceutical
适应症:血友病A
BioMarin基因疗法候选药物valoctocogene roxaparvovec也是一种基础AAV5基因疗法将于今年提交BLA。该疗法用AAV5表达凝血因子的病毒载体VIII用于治疗血友病的转基因A,这是一种罕见的遗传性出血性疾病。BioMarin2019年12月初,FDA提交了BLA,FDA需要进一步的后续数据。2022年1月,公司公布了全球三期临床试验两年后续安全有效数据,显示主次终点已达到。BioMarin计划于2022年第二季度在美国重新提交BLA,用于治疗严重血友病A,预计最早批准时间为2022年底。
7. 疗法名称:Eladocagene exuparvovec
公司:PTC Therapeutics
适应症:芳香族 L-氨基酸脱羧酶缺乏症
PTC Therapeutics的eladocagene exuparvovec(PTC-AADC)它是一种基因替代疗法,单剂量将人类多巴脱羧酶(DDC)基因被送到大脑壳核治疗芳香族L-氨基酸脱羧酶缺乏症(AADCD),一种罕见的遗传疾病影响大脑。来自三个一期和两期临床试验的五年结果分析表明,AADCD儿童的运动功能和认知能力不断提高。公司计划于2022年第二季度提交BLA。如果获得批准,这将是AADCD患者潜在的第一种上市治疗方法。目前,根据公开领域的信息,该疾病领域还没有其他基因疗法进行后期临床试验。
8. 疗法名称:Afamitresgene autoleucel
公司:Adaptimmune Therapeutics
适应症:膜肉瘤或粘液样/圆细胞脂肪肉瘤(MRCLS)
Afamitresgene autoleucel(afami-cel)是Adaptimmune Therapeutics公司开发的工程化靶向MAGE-A4抗原的T细胞疗法(MRCLS)2主要疗效已在期间研究中结束。基于积极的结果,Adaptimmune准备在2022年第四季度提交一份滑膜肉瘤BLA申请。目前,手术是滑膜肉瘤的首选治疗方法,部分患者会在手术前后接受放射治疗。若获批准,afami-cel为患者群体提供更高生活质量的替代治疗。
9. 疗法名称:CTX001
公司名称:CRISPR Therapeutics、Vertex Pharmaceuticals
适应症:β地中海贫血;镰刀型细胞贫血
CTX001它是一种非病毒载体基因编辑疗法,由非病毒载体组成CRISPR Therapeutics和Vertex合作开发用于治疗输血依赖性β地中海贫血(TDT)或严重镰刀型贫血病(SCD)患者在体外改造造血干细胞,使红细胞产生高水平胎儿血红蛋白(HbF)。该疗法已完成其正在进行的三期研究的患者给70多名患者服药。CTX001已获得美国FDA授予治疗TDT和SCD先进的再生医学疗法(RMAT)以及快速通道和孤儿药资格。Vertex计划于2022年底提交CTX001用于治疗这两种适应症的世界(包括美国)FDA)监管申请文件。
10. 疗法名称:EB-101
公司:Abeona Therapeutics
适应症:隐性营养不良型大疱性表皮松解症
今年预计将在美国提交另一份上市申请COL7A1基因靶向疗法是Abeona的EB-101。这种疗法是一种体外基因校正的自体细胞疗法,将COL7A1胶原蛋白基因插入患者自身的皮肤细胞(角质形成细胞)。该疗法正在进行三期安全有效性临床试验,用于治疗隐性营养不良性大疱性表皮松解症(RDEB),这是一种罕见的结缔组织疾病,目前尚未得到批准。在1/2期研究中,EB-101已显示出可观的伤口愈合和长达六年的长期疼痛减轻效果。Abeona已完成三期试验的患者,预计将于2022年第三季度提供一线结果,随后将于2022年底或2023年初提交BLA申请。
11. 疗法名称:OTL-103
公司名称:Orchard Therapeutics
适应症:Wiskott-Aldrich综合征
Orchard Therapeutics的OTL-103它是一种自体造血干细胞基因疗法,包括编码Wiskott-Aldrich综合征(WAS)慢病毒载体的基因转染CD34 细胞旨在单次注射治疗Wiskott-Aldrich综合征是一种罕见的遗传性免疫缺陷障碍。该疗法已获得。FDA孤儿药资格和罕见儿科疾病(RPD)资格。目前正在进行三期临床试验,以评估疗效和安全性,Orchard2022年初和2022年初计划FDA讨论它的潜力BLA申请。
