2021中国临床试验申报趋势全景解读
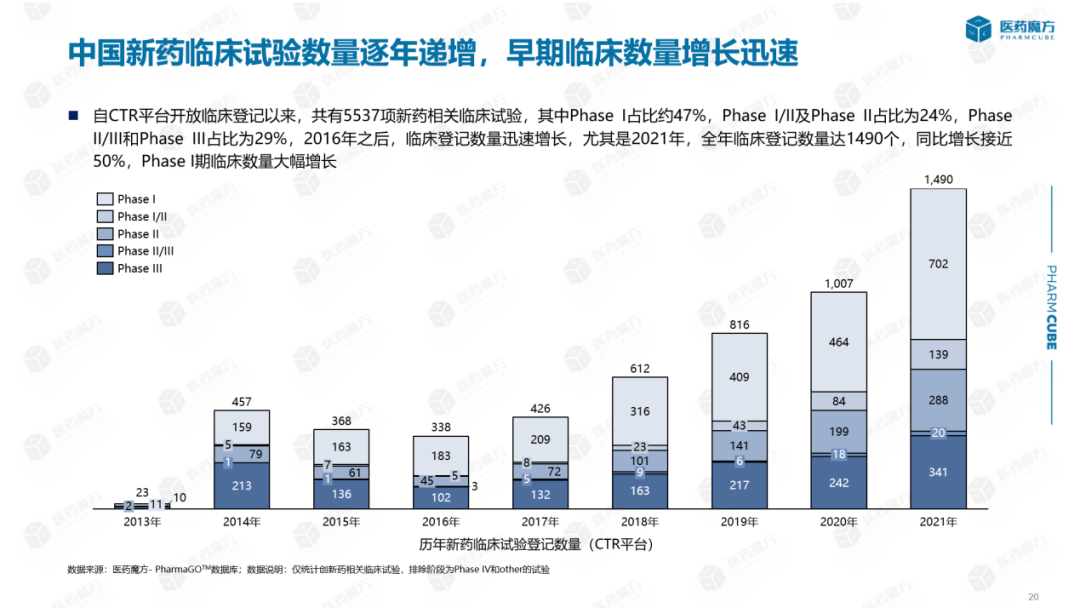
自CTR临床登记放临床登记以来,共有5537项新药相关临床试验,其中包括Phase I占比约47%,Phase I/II及Phase II占比为24%,Phase II/III和Phase III占比为29%,Phase II/III和Phase III比例较高的原因是进口药品直接在中国生产III期临床试验与不做早期临床试验有关。从整体趋势看:2016年以后临床登记数量迅速增长,特别是2021年,临床登记数量达到1490人,同比增长近50%。增长来源主要是一期临床新药登记数量大幅增加。
从2021年申报的近1500项临床试验的适应症分布可以看出,我国新注册的临床适应症仍以实体瘤为主,肝细胞癌、胃癌等消化道肿瘤的发病率相对较高。III临床上,这些临床主要跟随临床,PD-1相关,已有大量针对消化道肿瘤的PD-1产品接近批准阶段。此外,特应性皮炎、哮喘等疾病的临床实践也在进行中。随着2型炎症相关靶点的快速发展,特别是IL-4、IL-5、IL-快速推进13等靶点,带动中国相关产品爆发式增长。

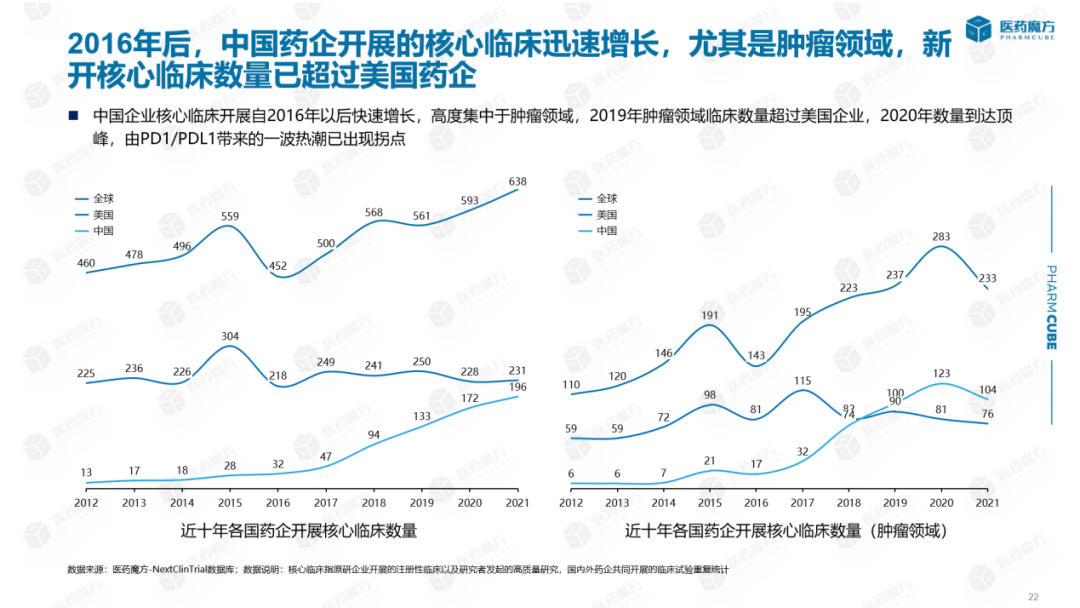
为了更准确地分析世界上所有企业最重要、最核心的临床应用,我们将原研究企业的注册临床和一些由研究人员发起的高质量研究定义为核心临床。从下图可以看出:2016年以来,全球核心临床逐年增长,在此期间,美国核心临床数量稳定在每年200多项,自2017年以来,中国企业核心临床发展迅速增长,2021年开展了近200项核心临床试验,数量接近美国核心临床发展。从临床试验分类来看:中国核心临床高度集中在肿瘤领域,2019年肿瘤领域核心临床数量超过美国,2020年达到顶峰,拐点也反映了自2016年以来的高度集中PD1带来的热潮已逐渐消退。
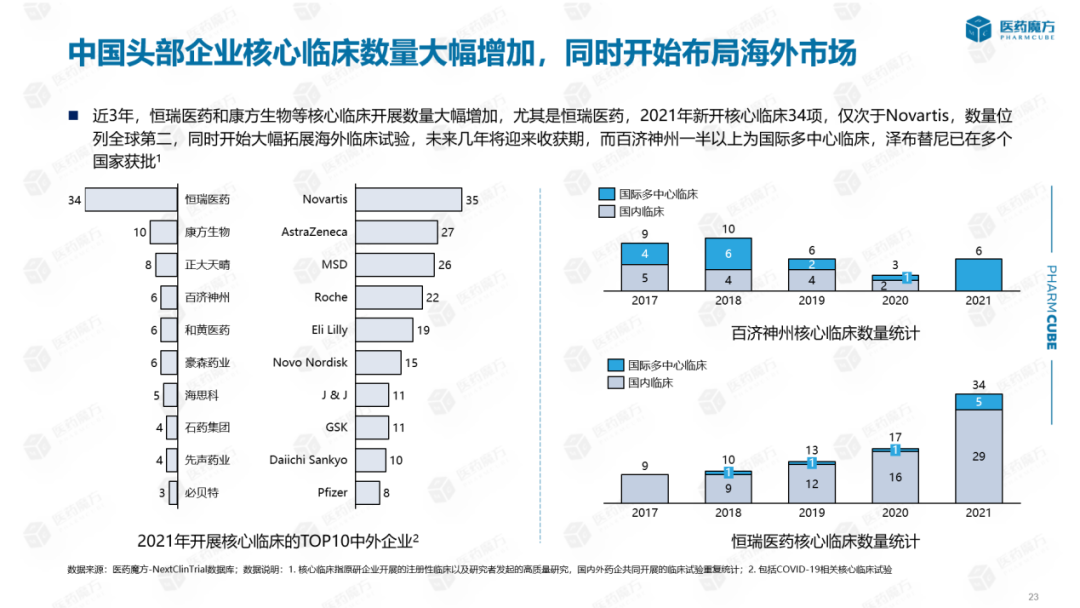
2021年开展核心临床的中外核心临床Top在企业中,诺华开展了35项核心临床实践,位居世界第一。恒瑞开展了34项核心临床实践,数量居世界第二,远远领先于国内其他企业。恒瑞的核心临床实践仅限于中国,国际多中心临床实践相对较少。然而,从2021年的应用领域来看,恒瑞已经开始大幅扩大海外临床试验。2021年,包括国际多中心临床实践在内的JAK抑制剂、PAP抑制剂还有PD1等相关药品。其他国内企业中,百济神州一半以上是国际多中心临床实践,泽布替尼已在多个国家获批,符合百济国际化发展战略。
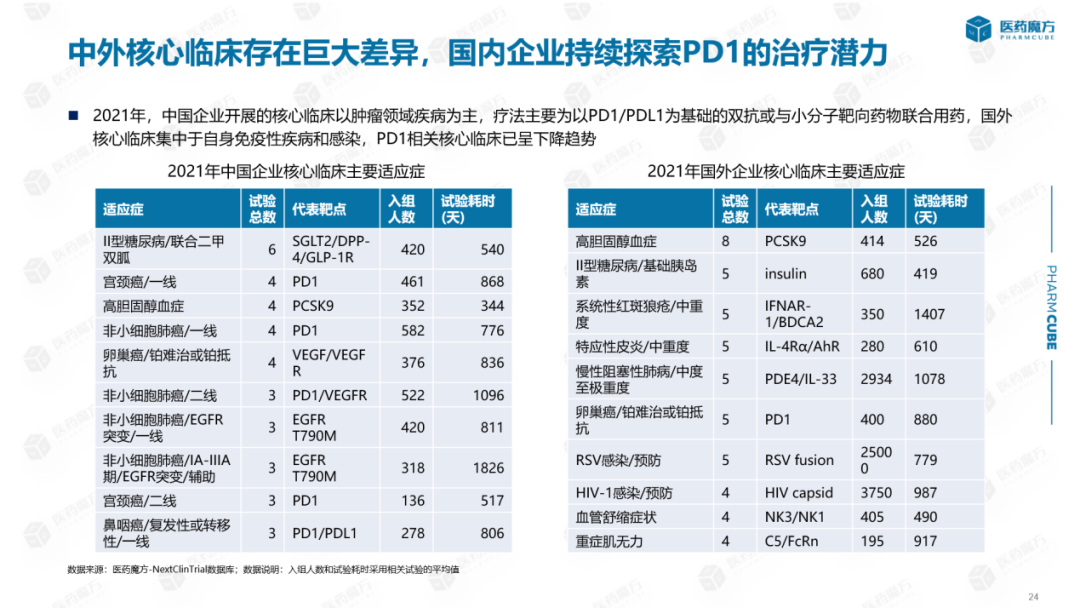
2021年,中国企业开展的核心临床以肿瘤病为主,治疗以肿瘤病为主PD1/PDL1.国外核心临床实践以自身免疫性疾病和感染为主,癌症比例相对较低,且与小分子靶向药物联合使用。PD1相关核心临床实践呈下降趋势。中外企业核心临床治疗也存在明显差异,从高胆固醇血症到高胆固醇血症。PCSK9靶点:目前国内核心临床主要针对PCSK9单抗,国外核心临床研究产品除单抗外,还有核酸药物,针对单抗,PCSK9单抗和核酸药物已获批上市。此外,还有基因疗法和口服多肽。这些新疗法可以大大延长给药间隔,实现3-每6个月给药一次,国内一些创新药物治疗迭代仍存在一定滞后。
总体趋势PD1/PDL2014年以来,1相关核心临床出现上升趋势,2019年以来,~2020年达到顶峰,随后出现明显下降趋势。中国企业。PD1/PDL1的核心临床实践占世界数量的近一半,但整体发展速度落后于世界3-四年的研发时间。因此,下一代制药公司需要积极探索下一代联合免疫疗法,即联合免疫疗法,即PD1联合LAG3,TIGIT等靶点药物治疗。此外,从全球和中国企业开展核心临床的成功率来看,近五年全球核心临床的成功率为70%,而中国企业核心临床的成功率为90%。PD1.它也是一个接近的数字,即中国企业的核心临床成功率明显高于世界。一方面,原因是近年来国内主要还在做me too产品在世界上有试错经验,我国开发的适应症相对集中,成功率相对较高;另一方面,国内一些失败的临床试验结果披露相对不完整,因此统计数字与真实值略有不同。


