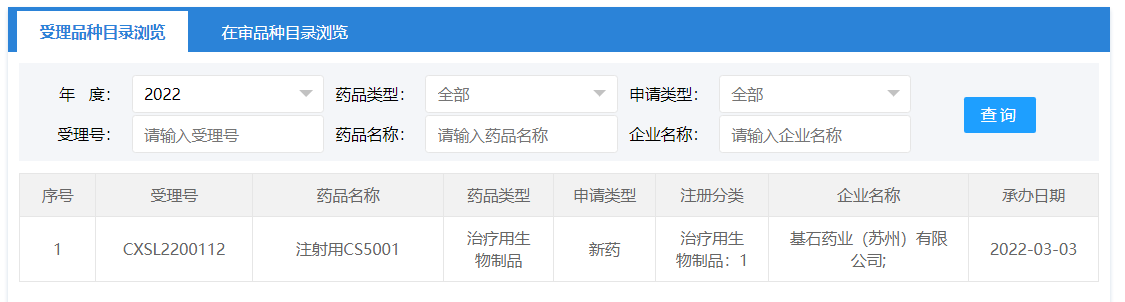
国内首款ROR1 ADC!注射基石药业CS接受5001临床试验申请
文丨阳光
3月3日,CDE官网显示,基石药业注射用CS接受5001临床试验申请。这是一种靶向酪氨酸激酶样孤儿受体1(ROR1)潜在的世界同类最佳抗体偶联药物(ADC),也是国内首款ROR1 ADC今年1月获得年1月获得,曾于今年1月获得,FDA批准临床。
CS5001最初由LegoChem Biosciences(LCB)开发。2020年10月,引进基石药业CS全球(韩国除外)5001开发商业权益,交易总额为3.预付款1000万美元(预付款33000万美元).53亿美元的里程金)。
ROR1是一种典型的肿瘤胚胎蛋白,在成人组织中低表达或不表达,在各种肿瘤中高表达(各种白血病、非霍奇金淋巴瘤、乳腺癌、肺癌和卵巢癌),潜力巨大ADC靶点。而CS5001是一种靶向ROR1的ADC,具有许多差异化特征,包括专有的位点特异性偶联、肿瘤选择性可切割连接器和前药技术。
通过定向偶联技术,CS5001结合了独特的β-葡萄糖苷酸连接子和吡咯并苯二氮卓类(PBD)前毒素二聚体。许多癌细胞中过度表达的溶酶体可以连接子和前毒素。β-切割葡萄糖醛酸酶。
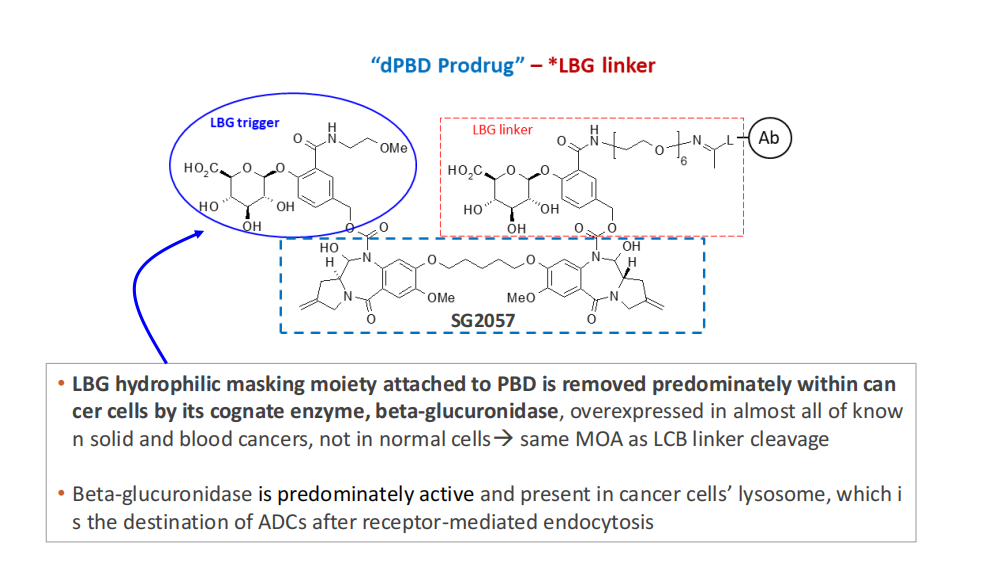
当CS5001被肿瘤细胞吞噬后,溶酶体β-葡萄糖醛酸酶会切割其连接器,释放出来PBD前毒素,然后PBD激活前毒素杀死肿瘤细胞。这种连接子和前毒素的双控制机制有效地减少了传统的双控制机制PBD负荷相关的毒性问题,并获得更大的安全窗口。
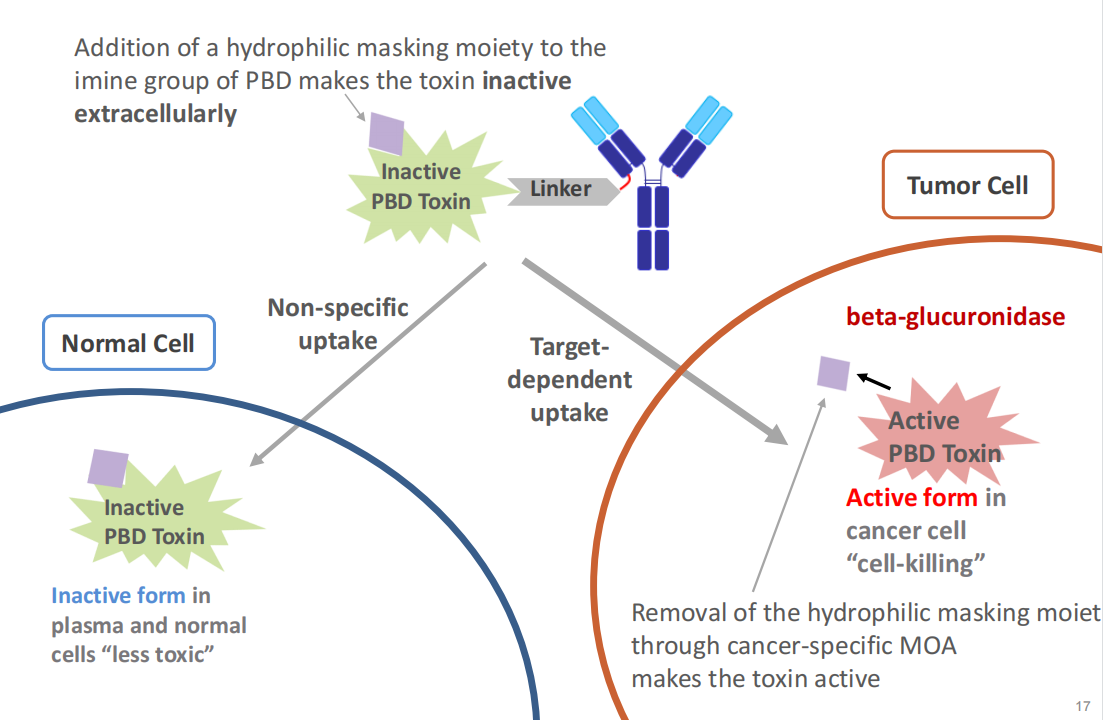
CS5001在几种临床前癌症模型中被证明具有完全的肿瘤抑制作用,并表现出良好的血清半衰期和药代动力学特性。这些都将转化为各种实体和血液恶性肿瘤的广泛治疗指标。CS5001利用定向偶联技术获得准确的药物抗体比率(DAR),便于实现均质生产和大规模生产。
目前,FDA批准的ADC共有11种药物(如下图所示)。中国也有4种药物。ADC药物上市是奥加伊妥珠单抗(Besponsa )、恩美曲妥珠单抗(Kadcyla )、维布妥昔单抗(Adcetris),还有荣昌生物的维迪西妥单抗(艾地希 ,仅在中国上市)。

关于ROR目标1,百利药业申报PD-L1/4-1BB/CD3/ROR14抗,是中国第一个ROR1靶向新药;默沙东的新药;Zilovertamab vedotin(MK-2140)今年1月13日在中国获批临床治疗复发性或难治性弥漫性大B细胞淋巴瘤。

