伏美替尼治疗转移性非小细胞肺癌的临床开始
据 Insight数据库显示,艾力斯最近已经注册并启动了伏美替尼治疗EGFR20 外显子插入突变局部晚期或转移性非小细胞肺癌(NSCLC)的 II临床实践。伏美替尼以前也在Ib针对 期临床EGFR 20.NSCLC 患者表现出初步疗效,今年5-5-6-6CDE突破性疗法程序中包括
临床试验登记详情

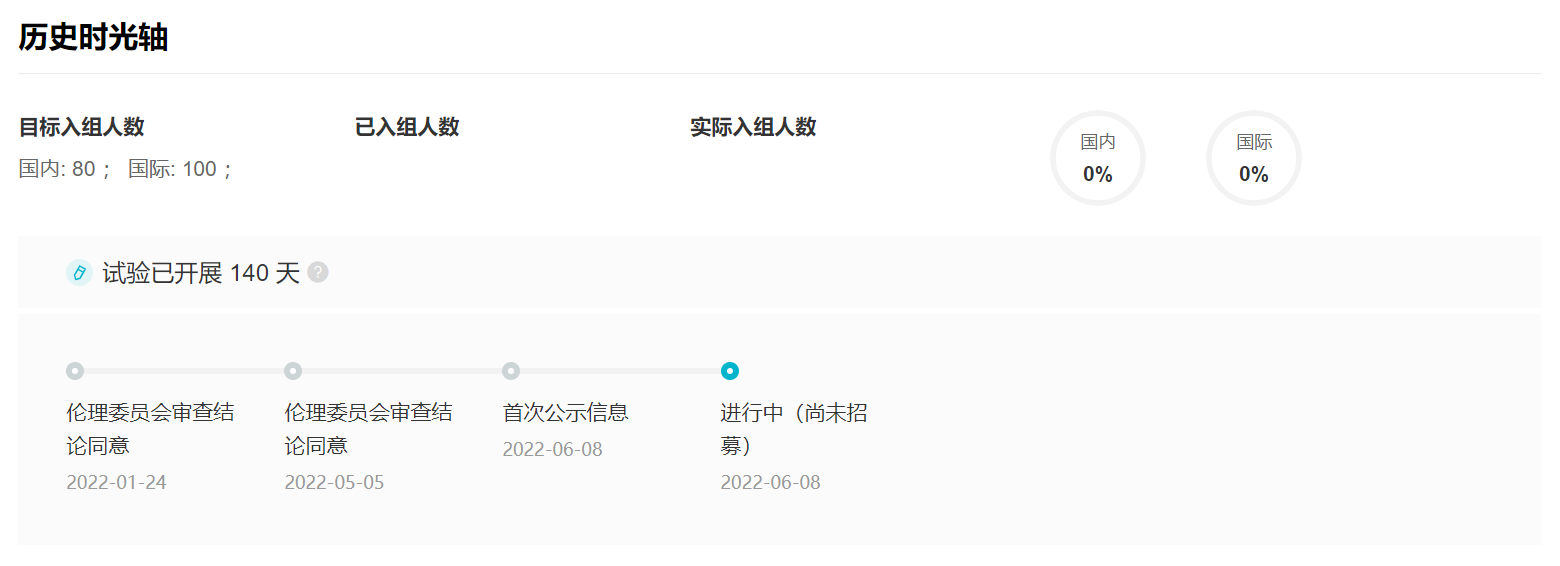
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
不仅伏美替尼,而且作为一种不能满足临床需求的肺癌基因突变类型,中国有 9 小分子新药布局。它仍然没有针对 EGFR外显子20NSCLC新药在中国获批,期待国内新药研发加快,为此类患者提供更有效的治疗方案。
EGFR外显子20
肺癌的发病率和死亡率是常年的TOP大癌种3.EGFR 突变占40%以上,因此针对EGFR 突变 NSCLC,各大药企纷纷开发新药,从一代到一代EGFR到四代 抑制剂EGFR 抑制剂,从小分子抑制剂到单抗、双抗等生物药物,各种新药百花齐放。
根据 NIH 数据,在EGFR在每个突变类型中,L858R 及 19Del 占80%以上,这类常见突变对一至三代EGFR-TKI致敏;比例高达50% T790M三代 突变EGFR-TKI 的主战场。20.显子插入突变是仅次于这两种突变的第三大突变类型。然而,这种突变是现有的一到三代EGFR-TKI 和免疫疗法都不敏感,因此临床上仍需开发相应的疗法。
EGFR每个突变类型的比例
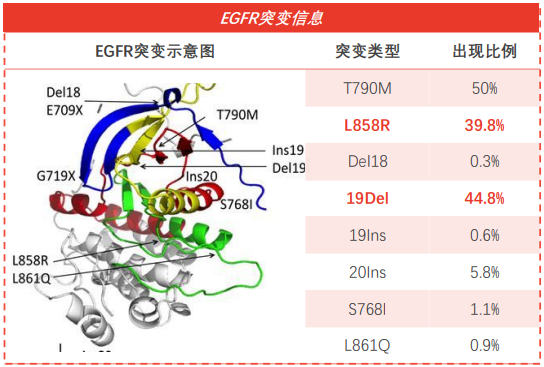
来自:NIH,整理头豹研究院
目前,世界上已经批准了两种新药EGFR 外显子20 插入突变,这两种新药均于2021年获批,但未在中国上市。第一个是强生制药EGFR/c-Met双特异性抗体Amivantamab,2021Ib 获取临床数据FDA 加速审批;随后在9999000年,武田制药EGFR-Ex20Ins 小分子 TKI Mobocertinib 基于 I/II也获得了 期临床数据FDA加速批准。两种靶向药物相继获批,为这类突变患者带来了新的治疗方案。
而在中国,武田在2021NMPA 递交了 Mobocertinib 新药上市申请,并纳入优先审批,几乎与美国同步。强生制药Amivantamab同年11月, 也在中国开始注册III 期临床。
全球批准的药品和中国地区进展
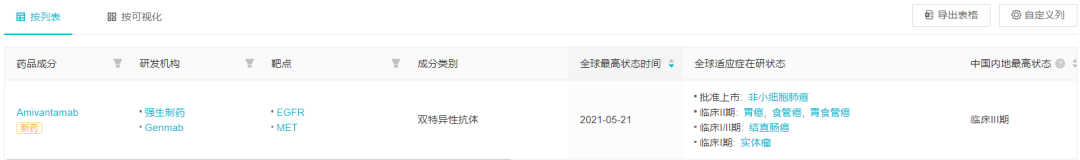

来自:Insight 数据库目标详情(http://db.dxy.cn/v5/home/)
三代 EGFR-TKI 针对 EGFR 20.NSCLC目前, 的治疗主要以高剂量给药的形式实现,对相应药物的安全性提出了更高的要求。伏美替尼在 I在 期剂量爬坡试验中,剂量增加240mg/d 耐受没有达到最大耐受剂量,因此该药物可以在后续展望中Ib三倍剂量可以240mg/d)在实验中没有进行疗效探索≥三级不良事件。
而据 Insight数据库显示,除了伏美替尼,还有其他开发适应症的方法EGFR-Ex20Ins 突变小分子靶向药物已在国内开发。Mobocertinib除此之外,韩美制药的波奇替尼和君景生物AP-L1898,再鼎医药CLN-081BEBT-109.II临床开发阶段。
EGFR-Ex20Ins目标竞争详情

来自:Insight 数据库目标详情(http://db.dxy.cn/v5/home/)
其中,舒沃替尼的舒沃替尼(DZD9008)是专门针对的EGFR 20 外显子插入突变进行差异化开发,也可以抑制EGFR-T790M 突变;而必贝特药物BEBT-109(
