2022年3月FDA发布药品审批计划!信达PD-海外上市将迎来最终决议
编译丨newborn
截至2022年2月底,美国FDA共批准了7种创新药物;其中,2月份批准了3种:
——Pyrukynd:Agios制药公司开发丙酮酸激酶缺乏症(PKD)成人患者,治疗溶血性贫血。该药是首次口服丙酮酸激酶激酶。(PK)激活剂也是第一种治疗方法PKD疾病修正疗法(DMT);
——Enjaymo:赛诺菲用于治疗冷凝集素病(CAD)成人患者,减少溶血引起的红细胞输注需求。该药是丝氨酸蛋白酶酶的第一种。C1s靶向单抗是第一种治疗方法CAD的药物。
——Vonjo:CTI生物制药公司开发用于治疗血小板计数低于 50 的骨髓纤维化成人×10 9 /L。Vonjo(pacritinib,被称为帕克替尼)属于一类JAK抑制剂抗炎药物。
此外,还有一种获批的创新疗法值得关注,2月28日,传奇生物开发的创新疗法BCMA CAR-T疗法Carvykti(cilta-cel,获得西达基奥仑赛FDA批准在美国上市,用于治疗成人复发和/或难治性多发性骨髓瘤(R/RMM)。该疗法在美国正式获批上市,成为国内首个自主研发产品出海的成功典范。相关阅读:传奇生物cilta-cel获FDA批准上市,将与BMS第一款同类产品正面对抗,国产CAR-T靶点竞争蓄势待发
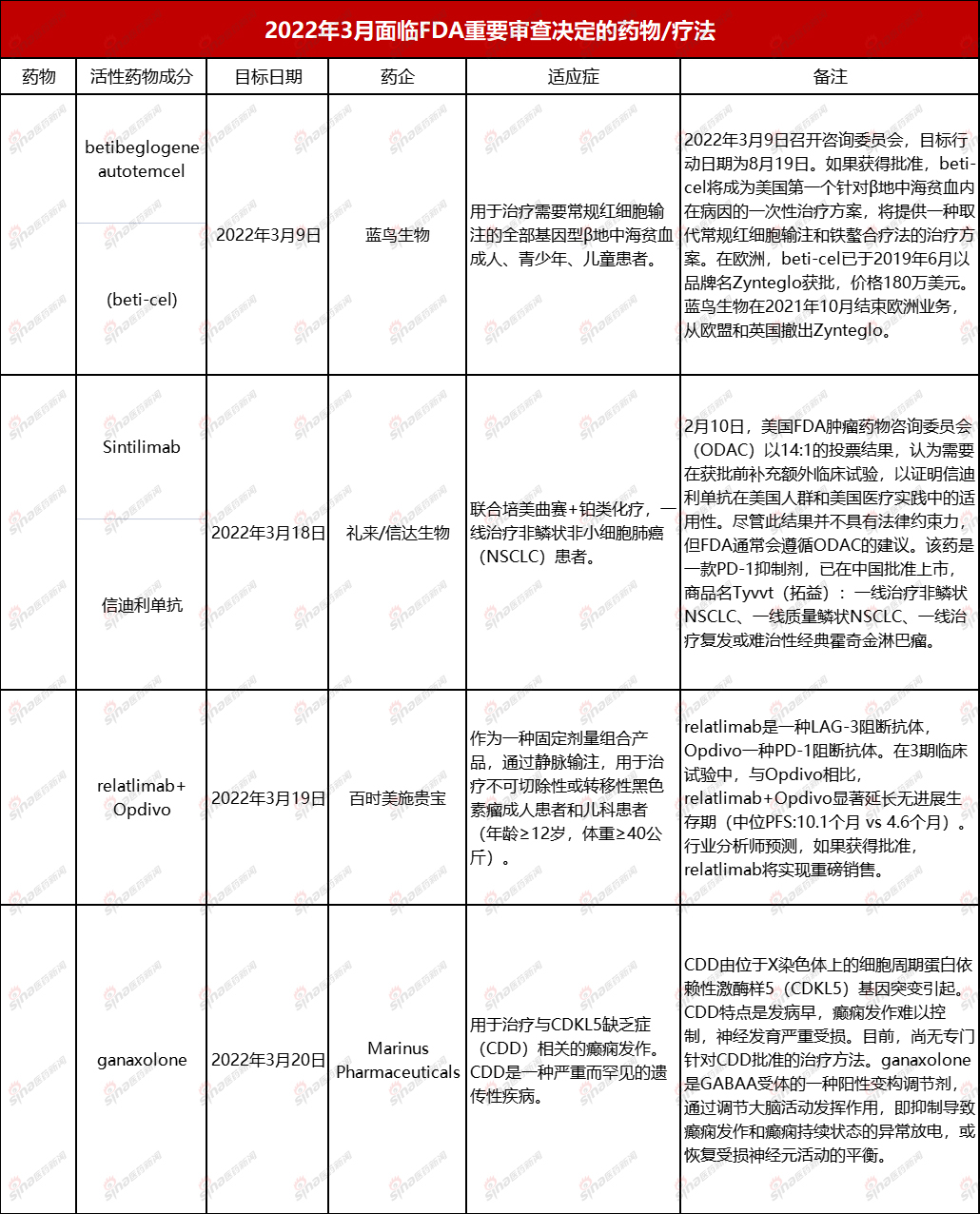
3月份,将迎来多种药物FDA礼来/信达生物是国内最受关注的重要审查决定之一PD-1疗法信迪利单抗。此前,2月初,FDA肿瘤药物专家委员会(Oncologic Drugs Advisory Committee,简称ODAC)对信迪利单抗的会议。相关阅读:14:11!FDA专家委员会要求信达/礼来/礼来PD-增加对美临床研究 不建议直接批准
审批会议结果:
委员会以14票赞成,1票反对,要求单一外国国家进行ORIENT-11临床试验(ORIENT-11研究是评估信迪利单抗注射液或安慰剂联合培美曲塞和铂用于治疗晚期或复发性非鳞状非小细胞肺癌的有效性和安全性的随机、双盲和三期对照临床研究,仅在中国进行,而不是全球多中心临床研究),以证明信迪利单抗在美国人中的适用性。
也就是说,从这次开始ODAC根据大多数专家的意见,信达/礼来PD-不建议直接批准。
正常情况下,FDA会遵照ODAC专家委员会的投票结果。但以前也有过。FDA没有采纳ODAC专家意见案例——Biogen阿尔茨海默病治疗药物Aduhelm。但是,考虑到两个不同的疾病领域和用药的选择性,作为来自疾病领域的药物,PD-信迪利单抗在拥挤的赛道上似乎很少有优势。
至于最终是否会出乎意料,我们等到本月18日结果出炉才能看出来。
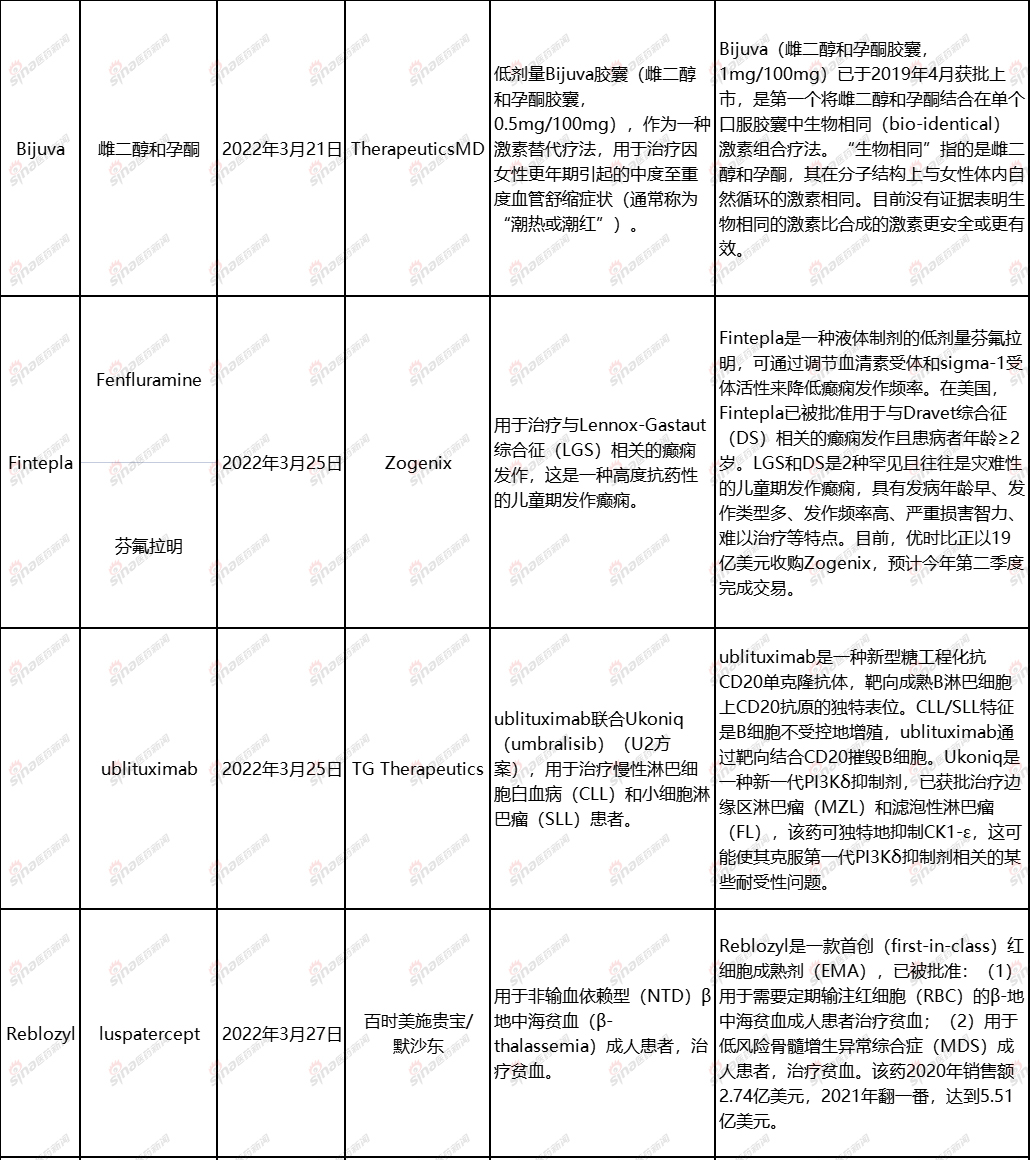
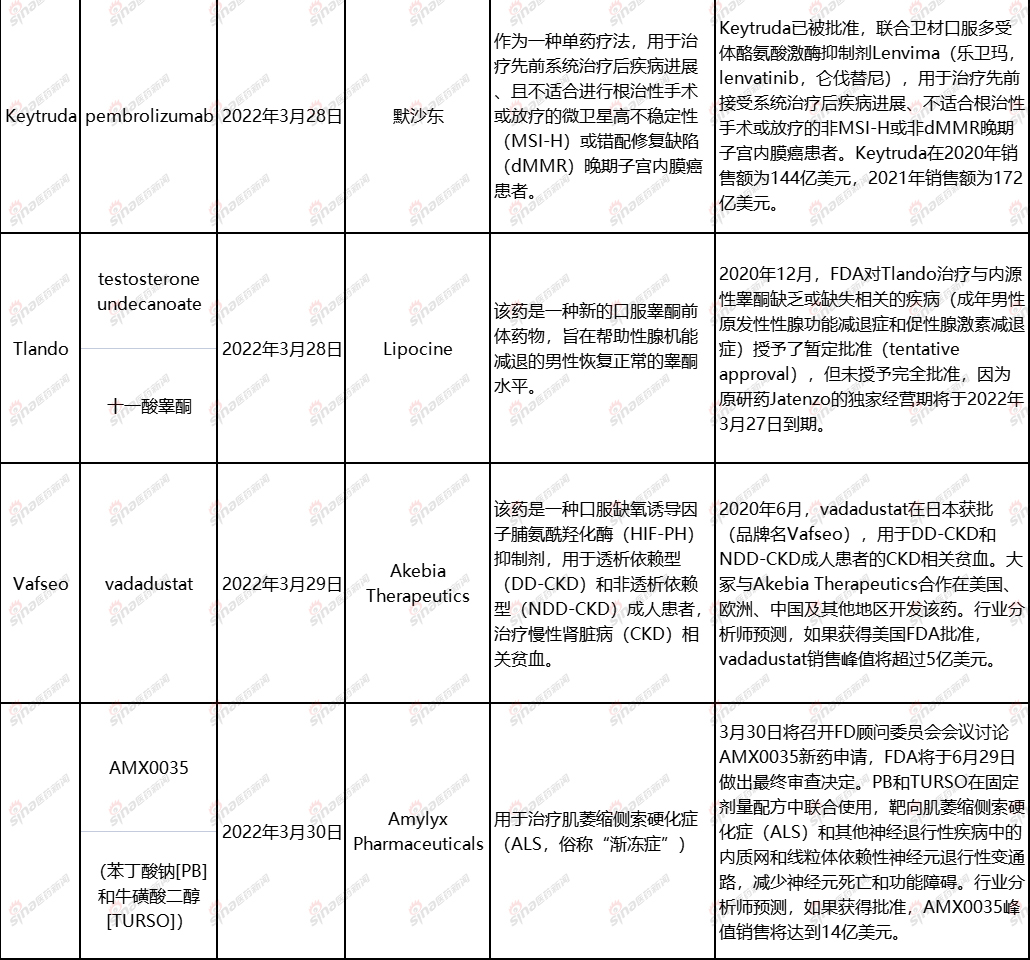
以下是3月份将面临的FDA简要总结药物/疗法。