超2.2亿美元引进!翰森制药的第一种生物药即将获批
文丨加一
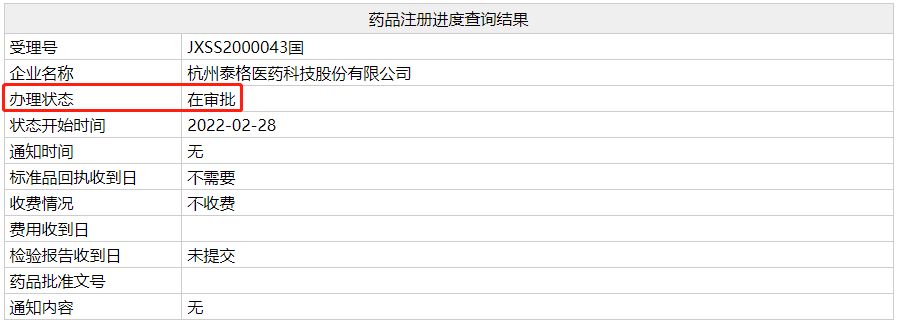
3月2日,据 Insight 数据库监控,翰森药业 CD19 单抗 Inebilizumab 注射液上市申请进入行政审批阶段,预计近期获批上市,用于视神经脊髓炎谱系障碍(NMOSD)。
如果获批,这将是翰森制药首批获批上市的生物药。2019年 5月,翰森制药超过 2.首付2亿美元 里程碑支付获得了该药在中国的发展和商业化权益。
受理号审查状态(NMPA 官网)
作为豪森引进的第一款生物药, 之前Inebilizumab 已在 FDA 获批后,我国疾病领域仍有未满足的需求,前景良好。
国内首款 CD19 单抗
Inebilizumab 是对 CD人源化单克隆抗体具有高度的亲和力。目前国内还没有 CD19 单抗批准上市,Inebilizumab 是国内第一款,也是目前唯一上市的 CD19 单抗。
2019年 2 月,Inebilizumab 获得美国 FDA 被授予突破性疗法认定并取得孤儿药资格,治疗罕见自身免疫性疾病视神经脊髓炎谱系障碍(NMOSD)。2020年 6 月,Inebilizumab 获 FDA 批准上市,商品名称为 Uplizna。
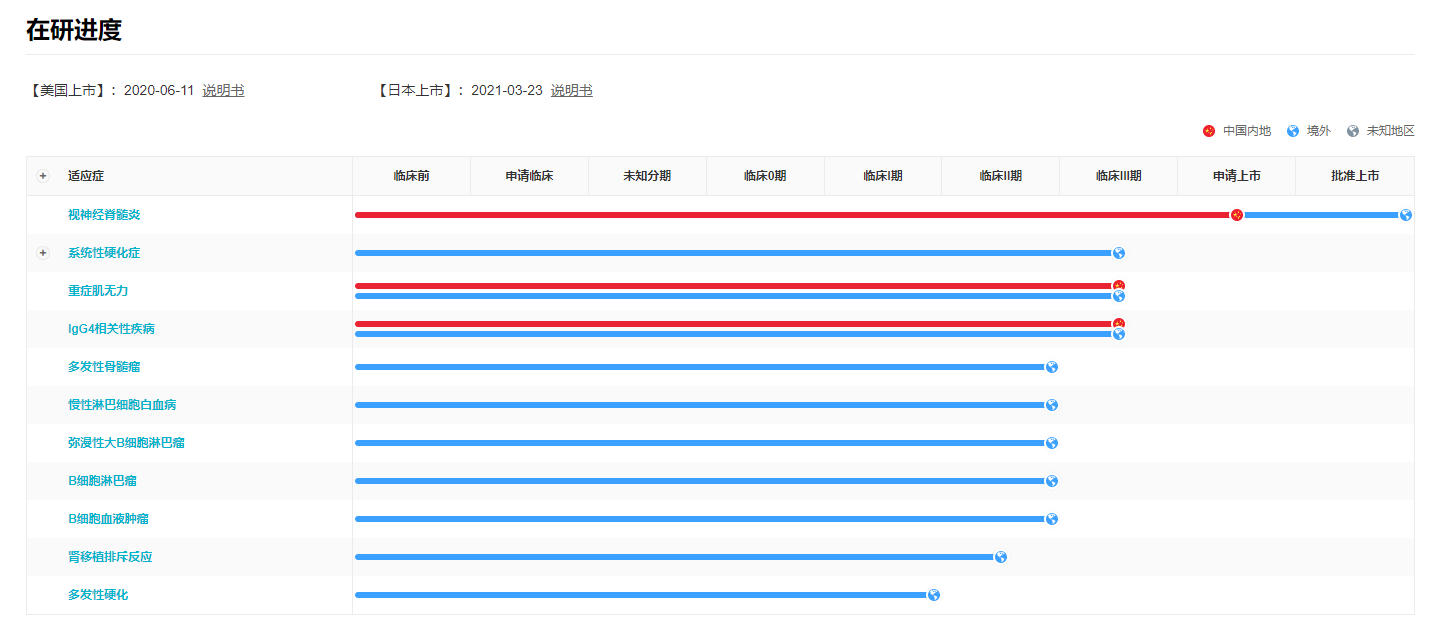
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
Inebilizumab 是 FDA第二款 批准NMOSD 治疗药物。目前,疾病领域 FDA 已批准三种抗体药物,另外两种是 Alexion 公司的 C5 抗体依库珠单抗(Eculizumab,商品名 Soliris)和罗氏的 IL-单抗萨特利珠单抗(Satralizumab),前者在中国尚未获批 NMOSD 适应症,后者于 2021年 4月在中国获批上市,商品名为安适平。
NMOSD 是一种罕见、严重、复发的神经炎症性自身免疫性疾病,其特征是视神经和脊髓的炎症性疾病。2018年5月被列入国家 121 罕见病目录。NMOSD 全球总患病率 1.82/10万,多见于亚洲患者,发病时平均年龄为 32.6-45.7岁,女性频繁。病人总是担心疾病的复发,每次复发都会使他们失去视力、行动能力甚至生命,给病人和家庭带来巨大的经济和心理负担。
Inebilizumab 在美国上市基于评估 Uplizna 疗效与安全N-MOmentum 临床试验。该试验入组 230 成年患者,其中 213 患者呈抗 AQP4 抗体阳性。为期197天的研究表明,与安慰剂治疗组相比,接受 Uplizna 治疗 161 名抗 AQP4 抗体阳性患者 NMOSD 复发风险降低 777%。

来自:Viela Bio 公司官网
根据 Insight 全球新药库,全球范围内,仅 2 款 CD单抗批准上市 上市,分别为 Inebilizumab 和 Tafasitamab。
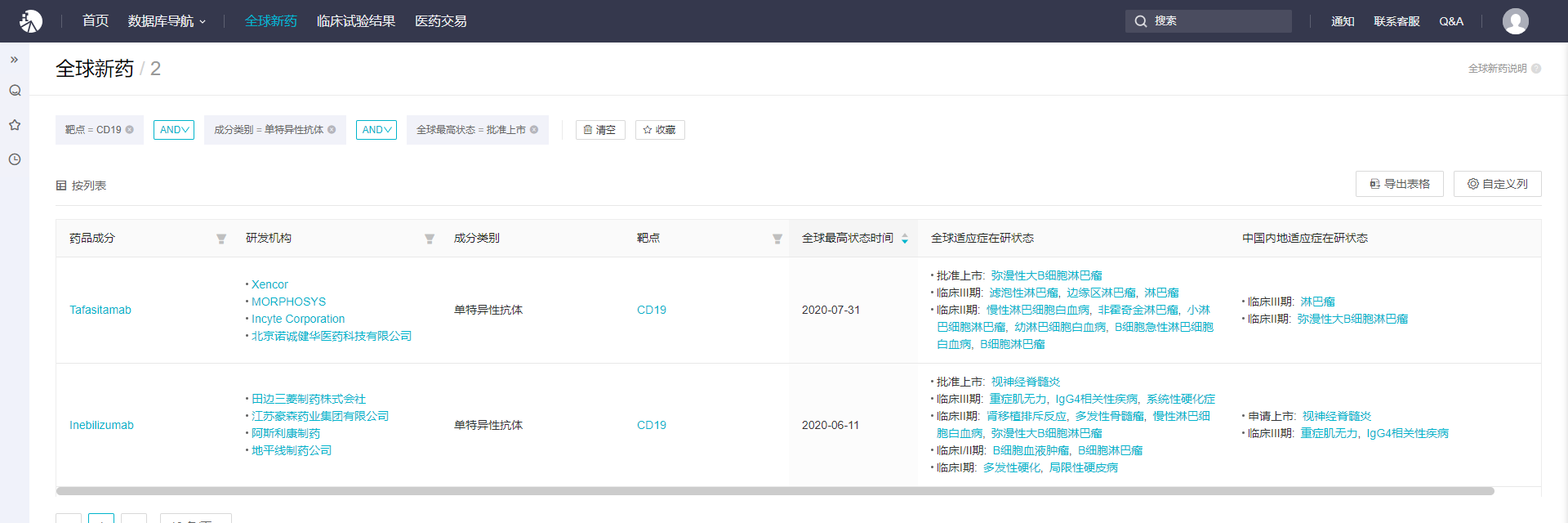
而在国内,Insight 数据库显示,目前 Inebilizumab 用于重症肌无力和 IgG4 相关疾病的适应症也在临床发展中,这意味着未来 Inebilizumab 有望扩大更多的适应症,覆盖更广泛的患者群体。
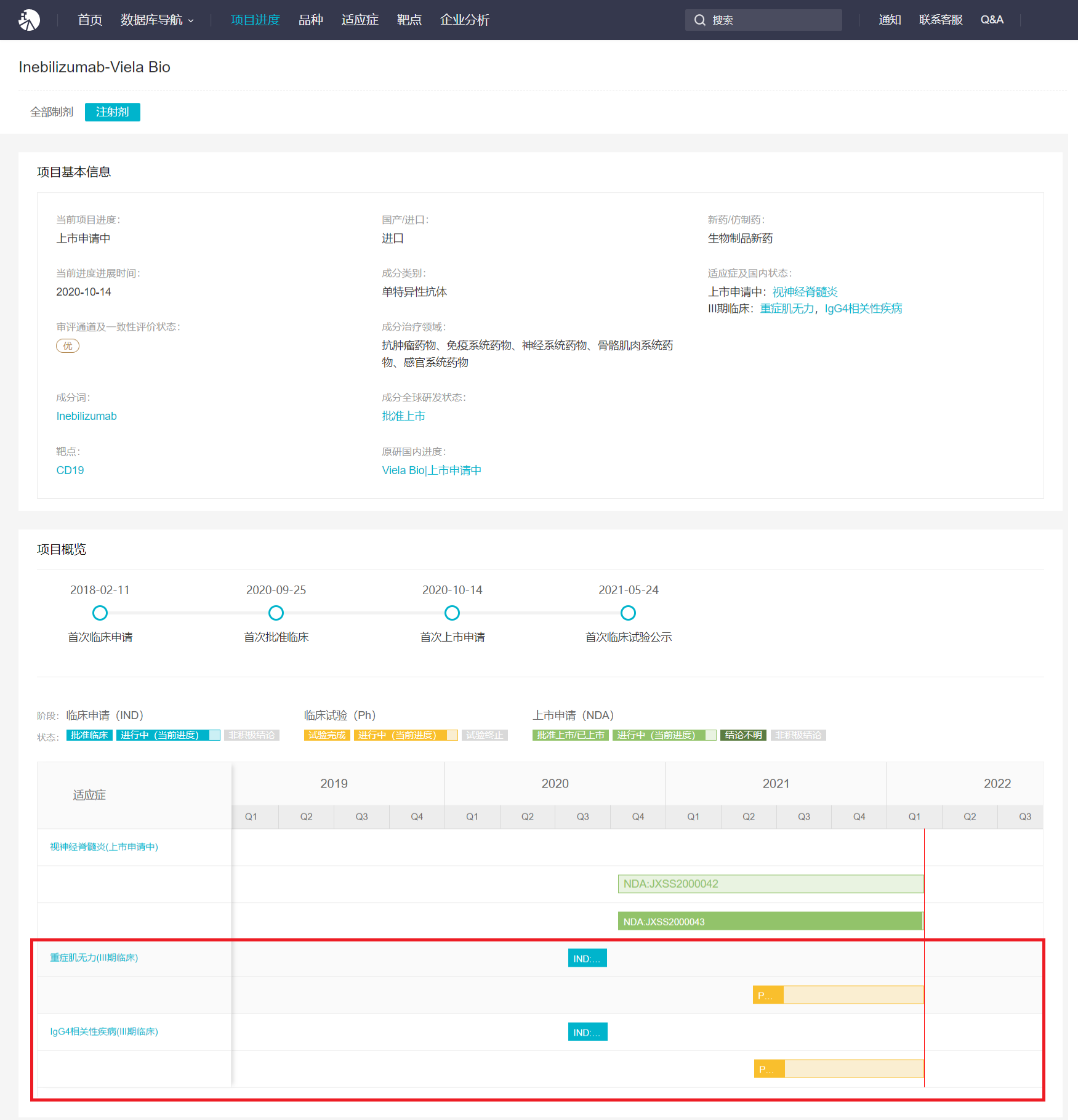
约 2.2 亿美元引进,翰森扩大生物药管线
根据 Insight 数据库,翰森制药的重点研发领域主要是小分子化学品,主要是小分子抗肿瘤药物,涉及 IDO、BRD4、ERK(MAPK)、SHP?2 等多个靶点;并且在 NASH 药物领域布局,先后提交 FXR 激动剂、ASK1 抑制剂、ACC化合物专利2 抑制剂。
在近年来生物药物的快速发展中,汉森早期布局相对谨慎,自主研发的第一种生物药物 HS-20090年(地舒单抗生物类似药物)于2020年 9月 18日首次启动临床,是其进展最快的生物药物;同时,根据专利信息,公司有新药抗 B7-H4 抗体研究,针对肿瘤免疫领域。
2019年5 月28日,豪森药业与 Viela Bio 达成战略合作,在中国开发 Inebilizumab 治疗 NMOSD 以及其他潜在的炎症/自身免疫和血液学恶性肿瘤适应症。根据协议,Viela Bio 有资格获得一笔前期合作费用,并超过 2.2 1亿美元的里程碑支付和基于产品净销售的分层版税,豪森药业负责中国开发和商业化的领导 Inebilizumab。
如若获批,Inebilizumab 也将是豪森首次引进抗体药物,也是目前唯一一种有助于扩大其生物药物管道的抗体药物。
2021年,翰森制药进入创新药申报爆发期,Insight 数据库 显示,全年多达 14 新药项目首次申请临床,包括 2 生物药 HS-20093 和 HS-20089。
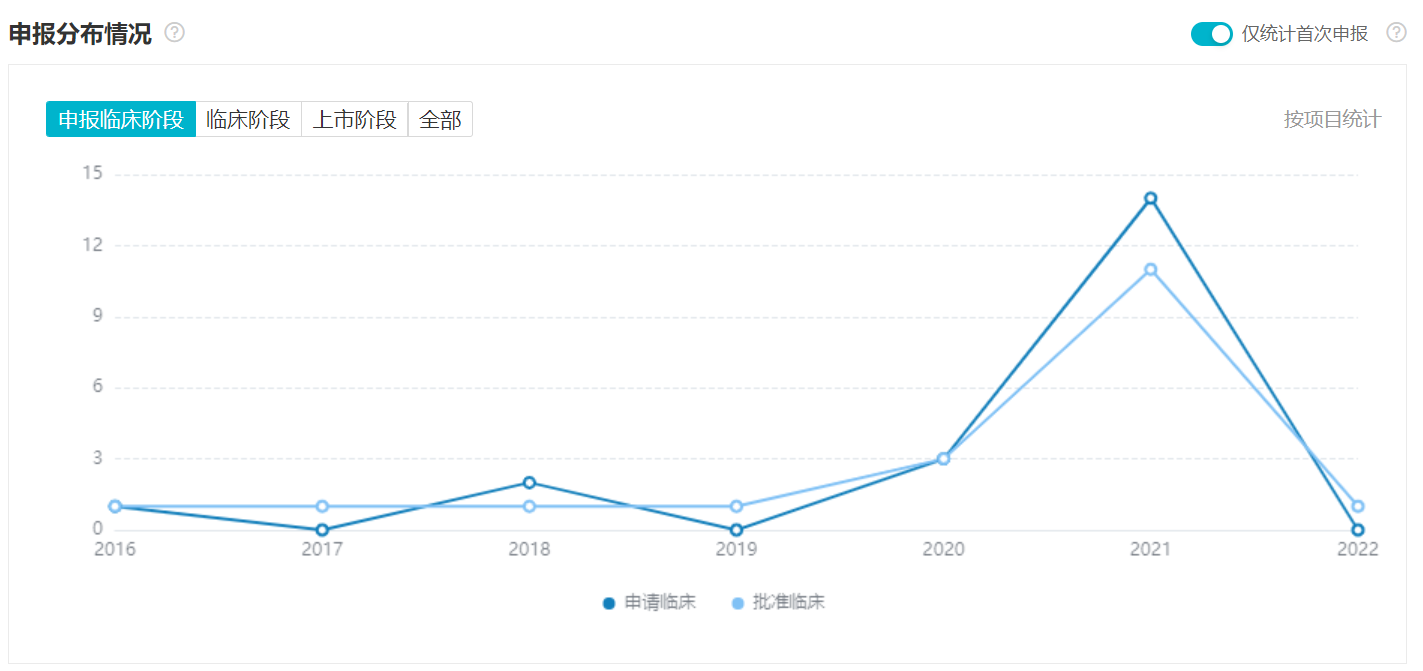
从治疗领域看,除 1 新药尚未披露拟开发适应症外,其他新药主要为肿瘤适应症(8)。临床进展速度也相对较快。2021年, 9 新药已启动临床试验。
Inebilizumab 由 Viela Bio 公司成立于2018年 2月,是阿斯利康生物制品业务子公司 MedImmune 中剥离 6个早期项目,获得博裕资本、通和玉成、高淳资本等知名风险投资机构共同领导的 2.5 亿美元 A 轮融资主要致力于开发和治疗严重自身免疫性疾病的药物。Inebilizumab同时,公司也获得了 FDA第一批新药具有重要的里程碑意义。
