百济、亚盛、永喜生物等ASCO最新临床数据公布于2022年
永喜生物将于2022ASCO年会期间公布BCMA/CD19双靶点CAR-T疗法GC012F治疗RRMM最新临床数据
5月27日,根喜生物宣布将在美国临床肿瘤学会2022年会议上以口头报告的形式出席(ASCO2022)上报B细胞成熟抗原(BCMA)/CD19双靶点CAR-T候选产品GC012F复发性/难治性多发性骨髓瘤(RRMM)由研究人员发起的多中心临床试验(IIT)最新临床数据。
GC012F双靶自体CAR-T同时靶向治疗BCMA及CD19治疗目标。候选产品依赖于公司的专属产品FasTCAR具有次日完成生产优势的平台技术。2021年11月,GC012F美国食品药品监督管理局(FDA)授予孤儿药资格,用于治疗多发性骨髓瘤。目前,中国正在一系列项目IIT评估多发性骨髓瘤的治疗方法(MM)和B霍奇金淋巴瘤(B-NHL)的效果。
从2019年10月到2021年11月,这项单臂,开放性,多中心IIT共有28例研究被纳入组中,他们接受了深度既往治疗RRMM患者和患者分别接受GC012F单次输注治疗三种剂量水平:x105细胞/公斤体重(DL1)、2x105细胞/公斤体重(DL2)和3x105细胞/公斤体重(DL3)其中,2021年有9例ASCO和EHA更新数据后,新增患者进入年会。.3%(25/28)mSMART 3.0被定义为高危患者的标准。所有患者中位前治疗线数为5倍。
截至2022年1月26日数据日,28例患者接受疗效评估,中位数随访时间为6.3个月(范围:1).8 - 29.9个月);目前,该研究仍在进行持续随访,以评估缓解深度。不同剂量水平的客观缓解率分别为,DL10000%(2/2),。DL80%(80/10)DL3:93.8%(15/16)(MRD)100%(27/27)00%(27/27)的患者达到MRD阴性;75%(21/28)的患者在严格意义上达到微小残留病变的阴性(MRD- sCR)。
GC012F安全性与以因子释放综合征的安全性与之前的观察结果一致(CRS)(0-2级:93%)CRS;没有观察到任何级别的免疫效应细胞相关神经毒性(ICANS)。这项研究将继续进行监测和评估GC012F患者在治疗过程中的有效性和安全性包括最佳的整体缓解率(BOR)并缓解持续时间(DoR)。
2022ASCO年会摘要
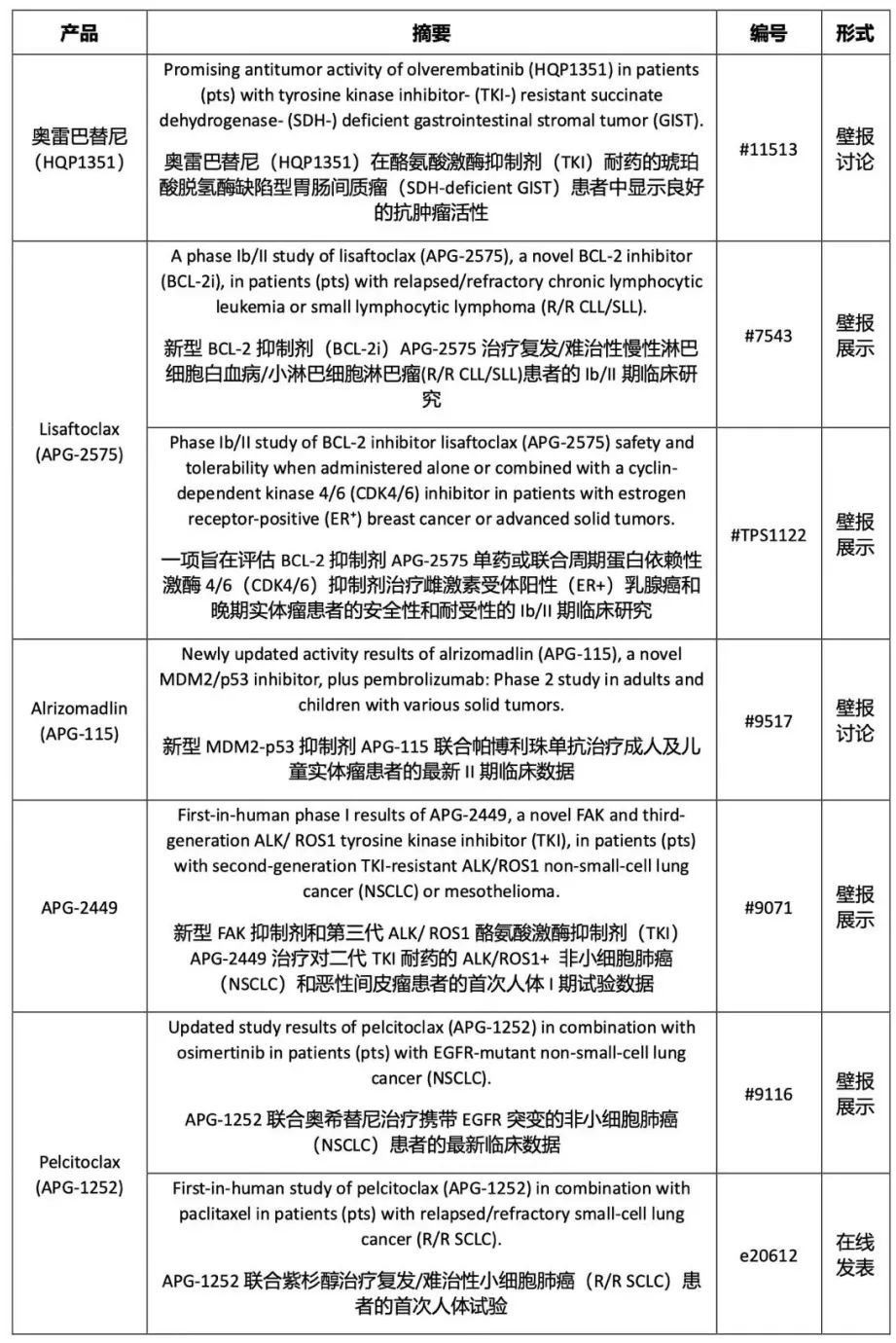
亚盛医药6855日.HK)宣布公司入选2022年美国临床肿瘤学会(ASCO)今天,年会的临床研究摘要已经在ASCO官方网站。这七项研究涉及第三代酪氨酸激酶抑制剂(TKI)奥雷巴替尼(HQP1351)、Bcl-2抑制剂APG-2575、MDM2-p53抑制剂APG-115、ALK/ROS1/FAK抑制剂APG-2449和Bcl-2/Bcl-xL抑制剂APG-原研品种1252。
亚盛医药将在今年ASCO年会展示的七项最新临床试验进展包括:
将于2022ASCO年会期间,实体肿瘤和血液肿瘤药物组合8项研究数据报告展示
百济神州27日宣布,美国临床肿瘤学会将于2022年6月3日至6月7日在芝加哥举行。(ASCO)其丰富的实体瘤和血液肿瘤药物组合中的八项研究数据报告在年会上展示。
本次展示的数据重点包括BTK百悦泽抑制剂?(泽布替尼)最新临床数据:
·百悦泽?比较伊布替尼用于治疗华氏巨球蛋白血症患者的阶段ASPEN临床试验的长期安全性和有效性结果为43个月。
·百悦泽?与奥妥珠单抗相比,奥妥珠单抗治疗复发/难治性滤泡淋巴瘤患者2期ROSEWOOD主要分析临床试验结果。
除了宣布百越泽?根据最新的临床试验结果,百济神州还将在6月5日的总结和更新会议上关于其早期管道开发和百泽安?(替雷利珠单抗)3期临床试验RATIONALE海报上展示了309的结果。RATIONALE三十九是一项三期临床试验,评估百泽安?联合化疗对比安慰剂联合化疗,用于治疗复发性或转移性鼻咽癌患者。这些结果已于2022年4月19日公布ASCO全体会议系列会议进行了初步展示。
ASPEN研究:百悦泽?用于治疗华氏巨球蛋白血症的伊布替尼(WM)3期随机临床试验的长期随访结果
摘要编号:7510
中位随访时间为43个月,百悦泽?在WM患者不断表现出具有临床意义的有效性和可耐受的安全特征。
·探索性分析表明,与伊布替尼相比,百越泽?随着时间的推移,它显示出更深、更快、更持久的缓解
·百悦泽?获得完全缓解或非常好的部分缓解(CR VGPR)中位时间较短,为6.7个月(范围:1.9~42.相比之下,16个月的伊布替尼组.6个月(2个月).0~49.9个月)
·在随访期间,与伊布替尼相比,他接受了百越泽?很少有患者因不良事件而死亡、终止治疗和减少剂量
·在所有时间段内,与伊布替尼相比,百越泽?房颤、高血压和出血的发生率较低;接受百越泽?中性粒细胞减少的发病率随着治疗时间的推移而降低
百悦泽?联合奥妥珠单抗(ZO)对比奥妥珠单抗(O)治疗复发/难治性的单一药物(R/R)过滤性淋巴瘤(FL)病人:2期随机试验ROSEWOOD主要分析结果
摘要编号:7510
ROSEWOOD试验已达到主要目的地-中位随访时间为12.百月泽五个月?联合奥妥珠单抗组总缓解率(ORR)为68.奥妥珠单抗单药治疗组3%,45%.8%(p=0.0017)。百越泽?联合奥妥珠单抗治疗具有良好的整体耐受性,安全性结果与以往研究中对这两种药物的观察结果一致。
·百悦泽?联合奥妥珠单抗可以给患者带来深度和持久的缓解,完全缓解(CR)率为37.2%,奥妥珠单抗单药治疗组19%.4%;百悦泽?18个月的缓解率为70,联合奥妥珠单抗组.奥妥珠单抗单药治疗组9%,54%.6%
·百悦泽?在接受治疗后,奥妥珠单抗患者需要接受抗淋巴瘤治疗的时间显著延长,直到下一次(HR:0.37;p=0.0001)
·百悦泽?联合奥妥珠单抗组为27.4个月,奥妥珠单抗单药治疗组11个月.2个月(HR:0.51[95% CI,0.32~-0.81])
·百悦泽?奥妥珠单抗最常见的任何级别≥三级毒性是血液学毒性,其他毒性在两组之间相似
·在奥妥珠单抗单药治疗组中,输液相关反应更为常见
天演药业将于2022年ASCO公布抗CTLA-4安全抗体ADG126中期数据
27日业27日宣布,将公布ADG126 Ib/II 临床试验第一阶段剂量增加的中期数据显示了这种抗性CTLA-4单克隆抗体(mAb)具有潜在同类的最佳安全性。数据以摘要的形式发表在美国临床肿瘤学会上(ASCO)年会官网。会议将于2022年6月3日至7日在芝加哥举行。
摘要的标题是一种创新的掩盖抗性CTLA-4安全抗体ADG126的I在临床研究中,这种安全抗体可以实现对晚期实体瘤患者的肿瘤特异性激活,并有效地清除调节性肿瘤T关键数据如下:
在16名晚期转移性实体瘤患者的剂量递增试验中,约三分之一的患者接受了三线或三线以上的治疗,约三分之一的患者接受了免疫肿瘤的治疗(IO)治疗后病情进展。对于接受多线系统治疗的癌症患者,使用多线系统治疗ADG126单药每三周静脉注射一次,最大剂量为10mg/kg。
在所有剂量组的重复给药试验中,没有观察到与治疗有关的严重不良事件的剂量限制性毒性和治疗(SAE),只有一级治疗相关的不良事件(TRAE)。最常见的是疲劳(19%)和瘙痒(13%)。
代谢动力学(PK)近似线性,激活ADG126在不同剂量水平的重复给药过程中稳步积累。作为第一批验证SAFEbody临床数据,安全抗体精准掩蔽技术,ADG总半衰期增加126.7倍,相对于激活ADG126在人体中PK增长表明肿瘤微环境中的安全抗体(TME)中定向激活,药物在肿瘤组织中的稳定积累和延长暴露,从而增强作用。
它表现出早期抗肿瘤活性。两名接受多线治疗的冷肿瘤患者,一名为卵巢肿瘤,另一名为经纳武单抗(nivolumab)与伊匹单抗(ipilimumab)葡萄膜黑色素瘤联合治疗后病情进展,给药后两个目标病灶肿瘤持续减少,超过20%,CD8 T可能是因为细胞数量增加到1mg/kg在低剂量下重复给药后TME活化的ADG126 积累稳定,发挥作用。卵巢癌患者通过ADG126剂量为1 mg/kg第七种治疗方法,表征肿瘤生物标志物的临床效益CA-125值下降高达77%。
截至2022年2月15日,16例患者中有5例病情稳定,包括卵巢癌患者和葡萄膜黑色素瘤患者。在本试验中,给药剂量增加到20 mg/kg,而10 mg/kg也开始了剂量量。
